Im Rahmen der histopathologischen Befundung wird eine Vielzahl von Parametern erhoben, durch die insbesondere im Rahmen der onkologischen Diagnostik die weitere Therapie gebahnt, beeinflusst und sogar bestimmt wird. Klassifikationen helfen dem Pathologen, die Befunde zu objektivieren und diese in strukturierter Form mitzuteilen.
Präneoplasien
Präneoplasien werden in der Regel graduiert. Dies dient der Prognoseabschätzung und damit zur Festlegung des therapeutischen Vorgehens.
Zervix
Zervikale intraepitheliale Neoplasien (CIN)
Die CIN werden entsprechend der WHO-Klasssifikation eingeteilt.
Die Einteilung der CIN erfolgt nach einem dreistufigen System. Die CIN 1 entspricht einer geringgradigen squamösen intraepithelialen Läsion. Die CIN 2 und 3 entsprechen einer hochgradigen squamösen intraepithelialen Läsion. CIN 3 entspricht einem Carcinoma in situ.
-
Geringe Dysplasie (CIN 1):
Dysplastische Zellen und wenige Mitosen bevorzugt im basalen Drittel des Epithels. Obere zwei Drittel des Epithels mit Zeichen der Ausreifung. -
Mäßige Dysplasie (CIN 2):
Dysplastische Zellen bevorzugt in der basalen Hälfte bis Zweidritteln des Epithels oder dysplastische Zellen mit schweren nukleären Atypien im basalen Drittel des Epithels. Stärkere nukleäre Atypien als bei CIN1. Mitosen in den basalen Zweidritteln des Epithels, teilweise atypische Mitosen. -
Schwere Dysplasie (CIN 3):
Dysplastische Zellen den basalen Zweidritteln des Epithels bis kompletter Schichtungsverlust. Mitosen in allen Epithelschichten, atypische Mitosen.
Kolon
Intraepitheliale Neoplasien (IEN) des Kolons
Nach der neuen WHO-Klassifikation (2000) wird der Begriff “Dysplasie” durch den Terminus “intraepitheliale Neoplasie” ersetzt.
Für die intraepitheliale Neoplasie (IEN) wird ein zweistufiges Gradingsystem angewandt:
-
Geringgradige intraepitheliale Neoplasie:
Adenomähnliches Wachstum mit tubulärer/tubulär verzweigter, seltener villöser Architektur. Auskleidendes Epithel zwei- bis dreireihig, zylinderförmig mit eosinophilem Zytoplasma und mit basal angeordenten (polaren) stiftförmigen KerneDieses Epithel reicht bis zur Oberfläche und zeigt keine Ausreifung. -
Hochgradige intraepitheliale Neoplasie:
Mehrreihiges eosinophiles Zylinderepithel mit vesikulären, hyperchromatischen, anisomorphen Kernen, deren Polarität gestört ist. Die Kerne reichen bis in die obere Epithelhälfte. Irreguläre, dicht gelagerte Krypten mit schweren Architekturstörungen (Drüsen-in-Drüsen, siebförmiges Wachstum). Diese Veränderungen sollten in mehr als zwei Krypten vorliegen.
Mundhöhle
Mundhöhle: Plattenepitheliale Dysplasien
Das Grading plattenepithelialer Dysplasien ist wichtig für die Einschätzung des malignen Potentials hinsichtlich eines invasiven Tumorwachstums.
Das Grading der plattenepithelialen Dysplasien setzt sich zusammen aus dem Vorhandensein oder Fehlen von Eigenschaften des normalen Plattenepithels und Malignitätskriterien in verschiedenen Abschnitten des betroffenen Epithels.
| Eigenschaft | geringe Dysplasie | mäßige Dysplasie | hochgradige Dysplasie = Carcinoma in situ |
| SIN 1 | SIN 2 | SIN 3 | |
| dichte Kernlagerung | basal | bis in das mittlere Drittel | bis in das obere Drittel |
| Kernatypien | gering | mittel * | hoch |
| Chromatinverteilung | normal | Kernwandhyperchromasie mit zentraler Aufhellung | grobschollige Verklumpungen |
| Mitosen | basal | untere Hälfte | bis in das obere Drittel |
| Einzelzelldyskeratosen | keine | keine | möglich |
Barrett
Klassifikation intraepithelialer Neoplasien der Barrett-Mukosa
Intraepitheliale Neoplasien der Barrett-Mukosa unterliegen einer hohen Interobserver-Varianz. Im Rahmen einer Konsensus-Konferenz wurde ein Klassifikationsschema zur Standardisierung der Terminologie und Diagnostik erarbeitet.
Intraepitheliale Neoplasien werden wie folgt klassifiziert:
-
Keine intraepitheliale Neoplasie
-
Fragliche intraepitheliale Neoplasie, bzw. V.a. intraepitheliale Neoplasie
-
Geringgradige („low grade“) intraepitheliale Neoplasie
-
Hochgradige („high grade“) intraepitheliale Neoplasie
Histologische Merkmale der gering gradigen („low grade“) intraepithelialen Neoplasie
-
Weitgehend erhaltene Kryptenarchitektur
-
Zellpolarität weit gehend erhalten
-
Verschiebung der Kern-Plasma-Relation
-
Stäbchenförmige, mäßig hyperchromatische Zellkerne
-
keine Ausreifung nach luminal
-
Abrupter Übergang von nicht-neoplastischem zu neoplastischem Epithel
Histologische Merkmale der hoch gradigen („high grade“) intraepithelialen Neoplasie
-
Kryptenarchitekturstörungen mit Ausknospungen und Verzweigungen
-
Verlust der Zellpolarität
-
Hyperchromasie der Zellkerne
-
Vermehrte Mitosen, atypische Mitosen
-
Prominente Nukleolen
-
Keine Ausreifung nach luminal
Histologische Merkmale des Adenokarzinoms in Abgrenzung zur hochgradigen („high grade“) intraepithelialen Neoplasie
-
Extreme Verzweigung neoplastischer Drüsen mit Kalibersprüngen
-
Dissoziation neoplastischer Drüsen
-
Infiltration der Muscularis mucosae
-
Lymph- oder Blutgefäßeinbrüche
Vagina
Analbereich
Pankreas
Typing
Tumorhistologieschlüssel/Morphologieschlüssel
Maligne und präinvasive Tumoren werden bei uns histogenetisch klassifiziert und entsprechend den Anforderungen des Schleswig-Holsteinischen Krebsregisters anhand des ICD-O-M2 verschlüsselt.
Der Morphologieschlüssel wird im Befund vermerkt. Die Verschlüsselung ist so spezifisch wie möglich durchzuführen. Entitäten-übergreifende Morphologieschlüssel (z.B. Karzinom o.n.A..) sollen vermieden werden. Der Morphologieschlüssel wird in der Tumorklassifikation dem Grading und der pTMN-Klassifikation vorangestellt. Benigne Läsionen werden nicht verschlüsselt, d.h. nur Schlüssel mit den Suffixen 2, 3, 6 und 9 werden verwendet.
Es bedeuten:
-
MXXXX/0 : Tumor unklarer Dignität
-
MXXXX/1 : gutartiger, nicht metastasierungsfähiger Tumor
-
MXXXX/2 : präinvasiver Tumor, Carcinoma in situ, hochgradige Dysplasie
-
MXXXX/3 : invasiver, metastasierungsfähiger maligner Primärtumor
-
MXXXX/6 : Tumormetastase
-
MXXXX/9 : Maligner Tumor, unklar ob Primärtumor oder Metastase
Grading
Histopathologisches Grading
Histopathologisches Grading
Die Tumoren werden entsprechend der WHO und der UICC graduiert. Es bedeuten:
-
GX : Differenzierungsgrad kann nicht bestimmt werden.
-
G1 : Gut differenziert
-
G2 : Mäßig differenziert
-
G3 : Schlecht differenziert
-
G4 : undifferenziert
Bei bestimmten Entitäten gelten:
-
GB : Borderline-Tumor
-
G0 : Grading ist nicht vorgesehen (Diese Verschlüsselung sollte wegen möglicher Missinterpretation nicht verwendet werden!)
Die Begriffe hoch, niedrig, hochgradig, niedriggradig oder mittelgradig differenziert sollen nicht verwendet werden, da eine Gefahr der Verwechslung und Missinterpretation besteht (hoch differenziert vs. hoch maligne).
Besonderheiten:
-
Beim Prostatakarzinom wird das Grading entsprechend dem pathologisch-urologischen Arbeitskreises nicht mehr angegeben. Es wird nur noch das Gleason-Grading und die davon abgeleiteten Grading-Systeme angegeben.
-
Beim Mammakarzinom wird das Grading nach Elston et al. bestimmt.
-
Das Grading maligner Teratome des Ovars erfolgen nach Angaben des AFIP-Atlas of Tumor Pathology Vol. 23 p.270
-
Beim Schilddrüsenkarzinom beeinflusst die Morphologie und das Grading das pT-Stadium.
-
Beim Leberzellkarzinom wird das Edmondson-Steiner-Grading angewendet.
-
Beim Karzinom des Corpus uteri findet das Grading nach Creasman Anwendung.
Lit.:
-
S3-Leitlinien Mammakarzinom
-
Edmondson HA, Steiner PE (1954): Primary carcinoma of the liver: a study of 100 cases among 48900 necropsies. Cancer 7: 462-504
-
Creasman WT, Odicino F, Maisoneuve P et al. (2001): FIGO Annual report on the results and treatment in gynaecologcal cancer, vol 24. Carcinoma of the corpus uteri. J. Epidemiol. Biostat. 6: 45-86
-
TMN Klassifikation maligner Tumoren (7. Auflage), Springer-Verlag
Endometr.
Grading endometrioider Adenokarzinome des Endometriums
Das Grading des Typ I-Adenokarzinoms des Endometriums ist ein entscheidender Faktor zur Prognoseabschätzung.
Das Grading setzt sich aus den Faktoren „Wachstumsmuster“ und „Kernpleomorphie“ zusammen.
| G1 | G2 | G3 | |
| Wachstumsmuster* | bis 5% solider Anteil | 6-50% solider Anteil | über 50% solider Anteil |
| Kernpleomorphie** | gering | mäßig | hoch |
-
*solider Anteil: nicht squamös, nicht morulaartig
-
** hochgradige Kernatypien erhöhen das Grading um einen Malignitätsgrad (G1 à G2, und G2 à G3)
(nach WHO 2003)
Mamma
Grading invasiver Mammakarzinome
Invasive Mammakarzinome werden unabhängig von ihrer histogenetischen Klassifikation anhand eines Summenscores graduiert. Die S3-Leitlinie Mammakarzinome legt das Grading nach Elston und Ellis fest. Das Grading erfolgt bei allen invasiven Mammakarzinomen. Ausgenommen sind Fälle mit schlechter Konservierung oder bei zu geringer Probengröße (weniger als 10 HPF).
| Kriterien | Scorewerte | ||
| Tubulusbildung | > 75% | 1 | |
| 10 – 75% | 2 | ||
| < 10% | 3 | ||
| Kernpolymorphie | gering | 1 | |
| mäßig | 2 | ||
| stark | 3 | ||
| Mitoserate * (Mitosen/10 HPF) |
SFZ 25 | SFZ 20 | |
| 0 -10 | 0 – 8 | 1 | |
| 11 – 20 | 9 – 16 | 2 | |
| > 20 | > 16 | 3 | |
| Summenscore: 3 bis 9 | |||
| Summenscore | Grading | Definition | |
| 3, 4, 5 | G1 | gut differenziert | |
| 6, 7 | G2 | mäßig differenziert | |
| 8, 9 | G3 | schlecht differenziert | |
| *Die angegebenen Mitosen beziehen sich auf die Diagnostik-Mikroskope Leica DMLB und Leica DMl mit dem 40x-Objektiv und 10xOkularen mit der Sehfeldzahl 25 bzw. 20. | |||
Lit.: Elston CW and Ellis IO (1991): Pathological prognostic factors in breast cancer. I. The value of histological grade in breast cancer: experience from a large study with long-term follow-up. Histopathology 19:403-410
Niere
Graduierung von Nierenzellkarzinomen nach Fuhrman.
Das international anerkannte und am meisten verwendete Grading nach Fuhrman dient der objektiven Graduierung von Nierenzellkarzinomen.
| Grad | Kerngröße in µm |
Kernform | Chromatin | Nukleolen |
| 1 | unter 10 | rund | dicht | unauffällig |
| 2 | 15 | rund | fein-granulär | klein, nicht sichtbar bei 10xVergrößerung |
| 3 | 20 | rund/oval | grob-granulär | prominent |
| 4 | über 20 | pleomorph/ multilobulär |
hyperchromatisch, offen | Makronukleolen |
Literatur: AFIP: Tumors of the kidney, bladder, and related urinary structures. Murphy WM et al. 2004
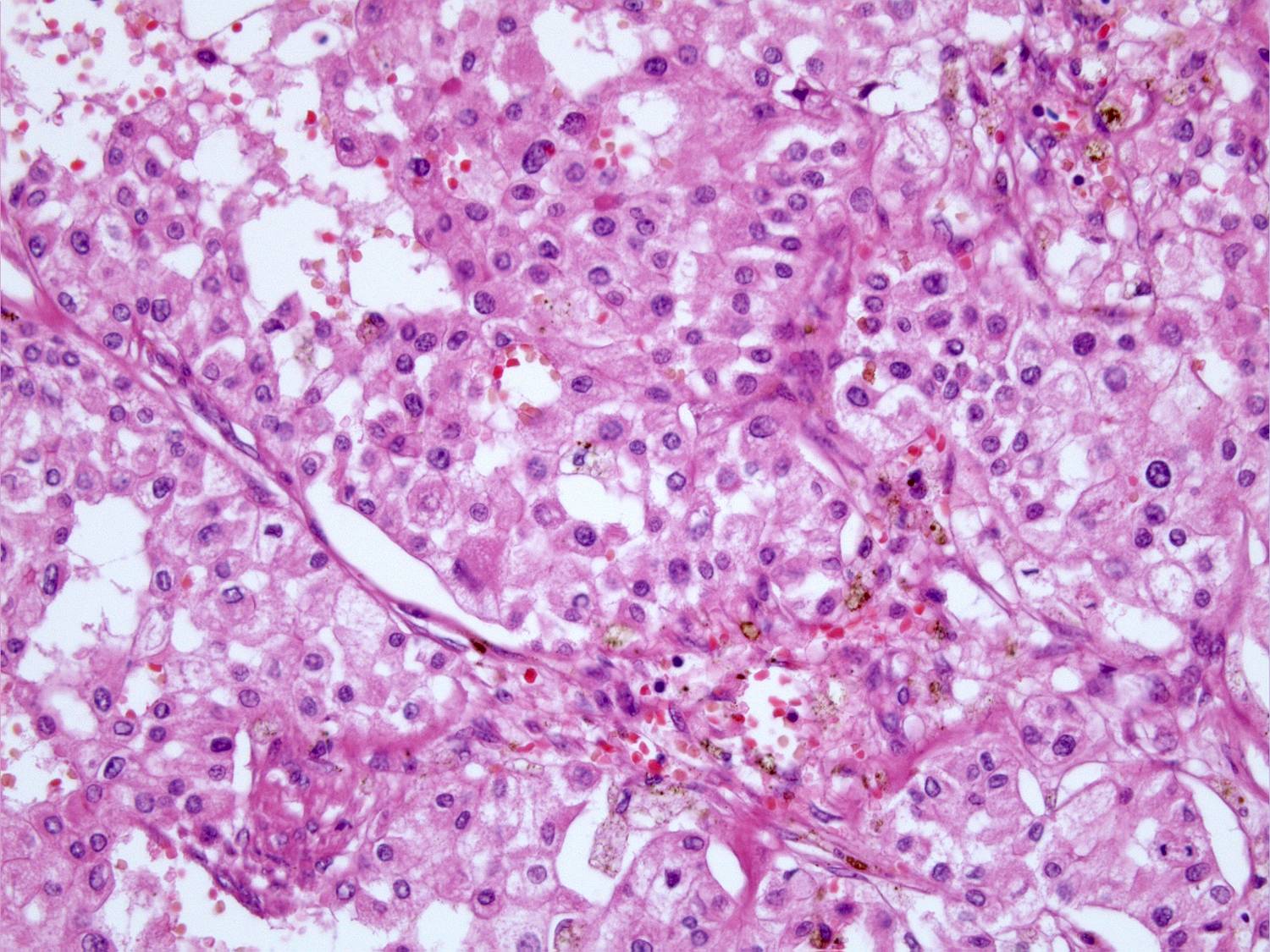
Nierenzellkarzinom
Ovar
Universelles Grading-System für Ovarialkarzinome nach Shimizu/Silverberg
Das Grading wird für alle rein epithelialen Karzinome des Ovars angewendet.
Beurteilt werden
-
das vorherrschende Wachstumsmuster,
-
der Grad der Kernpolymorphie und
-
die mitotische Aktivität.
Anhand des daraus resultierenden Summenscores erfolgt die Graduierung (Grad 1 = gut differenziert, Grad 2 = mäßig differenziert und Grad 3 = schlecht differenziert).
| Score-Wert | prädominantes Wachstumsmuster | Kernpolymorphie | Mitosen pro 10 HPF | ||
| SFZ 20 | SFZ 25 | 0,345 mm² | |||
| 1 | glandulär | gering | 0 – 6 | 0 – 8 | 0 – 9 |
| 2 | papillär | mäßig | 7 – 17 | 9 – 21 | 10 – 24 |
| 3 | solide | stark | über 17 | über 22 | über 25 |
| Grad 1 | Grad 2 | Grad 3 | |
| Summenscore | 3 – 5 | 6 und 7 | 8 und 9 |
Grading von Teratomen des Ovars
Primäre und metastatische (!) unreife Teratome werden histologisch auf der Basis des Anteils unreifen neuroepidermalen Gewebes gegradet.
Für das akkurate Grading von Teratomen muss ausreichend Material eingebettet sein (ein Block pro cm des Maximaldurchmessers des Tumors). Es wird der Flächenanteil unreifen neuroektodermalen Gewebes in Form von low power-fields (Objektiv 4x) pro Schnitt angegeben.
Es bedeuten:
-
Grad 0: Nur reifes neuroektodermales Gewebe.
-
Grad 1: Wenige Foci unreifen neuroektodermalen Gewebes mit einem Flächenanteil von weniger als einem low power-field in jedem Schnitt.
-
Grad 2: 2 oder 3 low power-fields unreifen neuroektodermalen Gewebes in irgendeinem Schnitt.
-
Grad 3: 4 oder mehr low power-fields unreifen neuroektodermalen Gewebe in irgendeinem Schnitt.
Ausnahmeregelung: Manchmal zeigen unreife Teratome nur verhältnismäßig wenig neuroektodermales Gewebe. In diesen Fällen kann auf der Basis unreifen non-neuronalen Gewebes, zum Beispiel zellreichem Mesenchym, gegradet werden.
Prostata
Grading von Prostatakarzinomen
Prostatakarzinome werden anhand des histologischen Wachstumsmusters graduiert. Das Grading erfolgt primär anhand des Gleason-Gradings und wird anschließend in das Grading nach Prognosegruppen entsprechend dem Vorschlag der ISUP (2015) übersetzt. Diese Gruppierung wird auch in der künftigen WHO-Klassifikation (2016) empfohlen. Zusätzlich erfolgt für die Krebsregistermeldung eine Übersetzung in das übliche Grading nach UICC (G1 bis G3). Das Grading des pathologisch-urologischen Arbeitskreises wird nicht mehr verwendet.
-
Das Gleason-Grading entspricht einem Summen-Score der beiden häufigsten Wachstumstypen eines Tumors. Finden sich mehr als zwei Wachstumsmuster, werden das flächenmäßig größte und das am schlechtesten differenzierte angegeben Es bedeuten:
-
Gleason-Pattern 1: gut umschriebene Knoten gleichförmiger, dicht gepackter, aber separater Drüsen (nicht an Prostatastanzen diagnostizierbar).
-
Gleason-Pattern 2: im Vergleich zu Pattern 1 schlechter umgrenzt, Drüsen sind lockerer gelagert und zeigen Kaliberschwankungen (nicht an Prostatastanzen diagnostizierbar).
-
Gleason-Pattern 3: invasives Muster mit Umwachsen von präexistenten Drüsen. Größen- und Formschwankungen der Drüsen, mikroazinäre Drüsen. Kribriforme Drüsen mit glatten abgerundeten Konturen werden nach dem aktualisierten Vorschlag des Gleason Gradings jetzt unter dem Muster 4 diagnostiziert. Drüsenverzweigungen sind innerhalb des Gleason-Pattern 3 möglich. Ebenso sollen Längsschnitte durch geschlängelte Drüsen, die eine Fusion vortäuschen, unter dem Gleason-Pattern 3 diagnostiziert werden. Im Zweifel zwischen Gleason-Pattern 3 und Gleason-Pattern 4 soll dem Gleason-Pattern 3 der Vorzug gegeben werden.
-
Gleason-Pattern 4: Drüsenfusionen aus mehr als zwei eindeutigen verschiedenen Drüsen, kribriformes, anastomosierendes oder glomeruloides Wachstumsmuster. Der Ausdruck „hypernephroid“soll nicht mehr verwendet werden
-
Gleason-Pattern 5: solides und dissoziierendes Wachstumsmuster, Tumornekrosen
Besondere Wachstumstypen werden im Gleason-Grading wie folgt klassifiziert:
-
Muzinöse Adenokarzinom wurden früher automatisch dem Gleason-Pattern 4 zugeordnet. Sie sollen heute entsprechend der oben angegebenen Wachstumstypen klassifiziert werden
-
Variabel/nicht definiert: Adenokarzinom mit neuroendokrinen Zellen, Plattenepithel- karzinom, adenosquamöses Karzinom, Adenokarzinom mit onkozytären Eigenschaften, kleinzelliges neuroendokrines Karzinom
Die aktuelle Übersetzungsliste des Gleason-Scores sieht wie folgt aus:
| Gleason-Score | Prognosegruppe | WHO |
| 2 -5 | I | G1 |
| 6 | I | G1 |
| 7a (3+4) | II | G2 |
| 7b (4+3) | III | G2 |
| 8 | IV | G3 |
| 9, 10 |
V |
G3 |
Sarkome
Grading von Weichteilsarkomen
Das FNCLCC-Grading entspricht einem Summen-Score. Voraussetzung der Anwendung ist die Einbettung von mengenmäßig ausreichendem und repräsentativem Tumormaterial (Grundregel: mindestens 1 Block pro 1 cm des Maximaldurchmessers).
Score für die Tumordifferenzierung im FNCLCC-System
| Histologischer Typ | ||
| Score 1 |
|
|
| Score 2 |
|
|
| Score 3 |
|
|
Einzel-Scores
| Score | Tumordifferenzierung (s. auch oben) | Tumor- nekrosen |
Mitosen | ||
| SFZ 18 | SFZ 20 | SFZ 25 | |||
| 0 | - | keine | - | - | - |
| 1 | Ausgeprägte Ähnlichkeit mit adultem Gewebe | < 50 % | 0 – 9 | 0 – 10 | 0 -13 |
| 2 | Sicherer histologischer Typ | > 50 % | 10 – 19 | 11 – 22 | 14 – 27 |
| 3 | Schlechte Differenzierung oder unsicherer histologischer Typ | - | ≥ 20 | ≥ 22 | ≥ 27 |
Summen-Scores
| Grad 1 | Grad 2 | Grad 3 | |
| Summenscore | 2-3 | 4-5 | 6-8 |
Foll. Lymphome
Grading von follikulären Lymphomen
Das Grading von follikulären Lymphomen wurde nach der WHO-Klasssifikation von 2001 entsprechend der Methode nach Mann und Berard durchgeführt. Für follikuläre Lymphomen wurde nach Berard ein dreistufiges Gradingsystem angewandt.
Im Bereich repräsentativer neoplastischer Follikel sollten 10 bis 20 HPF ausgewählt werden. Dabei werden sehr enge morphologische Kriterien an den Nachweis von Zentroblasten gestellt.·
Nach der aktuellen WHO-Klassifikation werden Grad I und Grad II als Grad I/II (low grade) zusammengefasst.
-
Grad I:
-
0 – 5 Zentroblasten pro HPF (“high power field”; x40-Objektiv; 0.159 mm²).
-
-
Grad II:
-
6 – 15 Zentroblasten pro HPF
-
-
Grad III:
-
> 15 Zentroblasten pro HPF
-
INach der aktuellen WHO-Klassifikation werden die follikulären Lymphome Grad 1 und Grad 2 als follikuläres Lymphom Grad 1/2 zusammengefasst.
Lit.: Mann RB, Berard CW (1983) Criteria for the cytologic subclassification of follicular lymphomas: a proposed alternative method. Hematol Oncol 1:187-192
Urothel-CA
Das Typing und Grading urothelialer Neoplasien dient der Behandlung und Prognoseabschätzung der urothelialen Läsionen.
Das Typing und Grading urothelialer Neoplasien erfolgt anhand des Wachstumsmusters, der Veränderungen im Urothel, des Vorhandenseins oder Fehlens der Deckzellen, der Anzahl und Verteilung von Mitosen und fakultativ der Stromaveränderungen.
| Papillom | PUNLMP | Nicht-invasives papilläres urotheliales Karzinom, low grade | Nicht-invasives papilläres urotheliales Karzinom, high grade | Urotheliales Carcinoma in situ | Invasives Urothel-karzinom | |
| Wachstum | papillär, ohne Fusionen | papillär, ohne Fusionen | papillär, mit Verzweigungen und Fusionen | papillär, mit Verzweigungen und Fusionen | flach | invasiv |
| Urothel | keine Atypien | max. minimale Atypiengering erhöhte Zelldichteüber 7 Zelllagen verbreitert | Polaritäts-störung der Kerne,geringe Pleomorphie | Polaritäts-störung der Kerne, hohe Pleomorphie | Polaritäts-störung der Kerne, hohe Pleomorphie | hohe Pleomorphie |
| Deckzellen | prominent | vorhanden | fehlen, aberrantes Muster für CK20 | fehlen, aberrantes Muster für CK20 | können vorhanden sein | fehlen |
| Mitosen | selten, dann basal | selten, dann basal | mäßig häufig | häufig | häufig | häufig |
| Stroma | Ödem, Enzündungs-zellen | Neo-angiogenese |
(nach WHO2004)
Lunge
Das Grading von plattenepithelialen Karzinomen der Lunge gilt als wichtiger prognostischer Marker für die Prognose.
Das Grading des Plattenepithelkarzinoms der Lunge setzt sich zusammen aus Wachstumseigenschaften in Höhe der Invasionsfront, der Größe der Tumorzellnester sowie dem Vorhandensein oder Fehlen von Interzellularbrücken.
Die Prognose wird jedoch vornehmlich bestimmt durch das Tumorstadium, nicht so sehr durch den Differenzierungsgrad, wobei Neoplasien mit stark ausgedehnten Nekrosen mit einer schlechteren Prognose assoziiert sind als solche ohne Nekrosen (WHO 2004).
| G1 | G2 | G3 | |
| Invasionsfront | abgerundet oder ausgefranst | abgerundet oder ausgefranst | ausgefranst, plump invasiv |
| Größe der Tumornester | variabel | variabel | variabel, aber oft klein und mit Einzelzellen |
| Verhornung der Zellen und Interzellularbrücken | prominent | fast immer vorhanden, aber weniger prominent | minimal oder fehlend |
| Hornperlen | oft | oft | selten |
Varianten des G3-Plattenepithelkarzinoms:
-
basaloides Plattenepithelkarzinom
-
kleinzelliges Plattenepithelkarzinom
-
spindelzelliges (sarkomatoides) Plattenepithelkarzinom (eigene Tumorentität nach WHO)
-
Lymphoepitheliom-ähnliches Plattenepithelkarzinom (nach WHO Subtyp des großzelligen Karzinoms)
(modifiziert nach Damjanow und Fan 2007)
Das Grading der pulmonalen Adenokarzinome wird als mit ausschlaggebender Prognosefaktor beschrieben. Das Grading der pulmonalen Adenokarzinome wird definiert über das Wachstumsmuster, die Kernpleomorphie und die Mitosehäufigkeit.
| G1 | G2 | G3 | ||
| glanduläre oder azinäre Strukturen | über 90% | 50 – 90 %, mit geringerer Reife oder abortiven Lumina | 50 – 90 %, gut differenziert | 5 – 50 % |
| Kernpleomorphie | gering | mäßig | hoch | hoch |
| Mitosen | wenig | mäßig reichlich | zahlreich | zahlreich |
(nach Damjanow und Fan 2007, in Übereinstimmung mit WHO 2004). Beachte Subtypen des Adenokarzinoms: hier gilt das Schema analog.
Das Grading neuroendokriner Tumoren der Lunge dient der Prognoseabschätzung und Therapie. Es setzt sich zusammen aus dem Wachstumsmuster, der Tumorgröße, der Mitoseanzahl, der Kernpleomorphie, dem Vorhandensein oder Fehlen von Nekrosen. Lokalisation des Tumors und die mögliche lymphogene Metastasierung dienen als weitere Faktoren zur Bestimmung der Tumorentität ebenso das immunhistochemische Markerprofil.
| Sog. karzinoide tumorlets | Typisches Karzinoid | Atypisches Karzinoid | SCLC | LCNEC | |
| Wachstums-muster | organoid-trabekulär, nesterartig, spindelzellig, papillär, pseudoglandulär, pseudorosetten bildend, folliculär | wie TC | solide | nesterartig, trabekulär, rosettenartig, perilobiät palisadenartig (neuroendokriner Aspekt) | |
| Größe des Tumors | unter 5 mm | über 5 mm | über 5 mm | ||
| Mitosen | unter2/2mm2 | unter 2/2mm2 | 2-10/2mm2 | (meist deutlich) über 10/2mm2 | (meist deutlich über) 10/2mm2 |
| Kern-pleomorphie | meist gering | gering bis hoch | gering bis hoch | mäßig, kleine Zellen, keine prominenten Nukleolen, typische Quetschartefakte | mäßig bis hoch, große Zellen, prominente Nukleolen |
| Nekrosen | - | - | + | +++ | +++ |
| Lokalisation | überall | überall | eher peripher | perihilär | peripher |
| LK-Metastasierung bei ED | 10-15 % | 40-50 % | sehr häufig | ||
| IHC | +: ChromoA Synaptophysin NCAM |
eher -:
TTF1+:
ChromoA
Synaptophysin
NCAM
eher -:
TTF1+:
ChromoA
Synaptophysin
NCAM
meist +:
TTF1+:
ChromoA
Synaptophysin
NCAM
+/-:
TTF1
-:
34betaE12
(nach WHO 2004)
Kolon
Kolon: Adenokarzinome, GIST, TME
Das Grading von kolorektalen Adenokarzinomen gilt als prognostischer Marker.
Die Klassifikation gilt für gewöhnliche Adenokarzinome des Kolons.
Muzinöse und siegelringzellige Karzinome werden nach G3 gegradet, kleinzellige und medulläre Karzinome (mit Mikrosatelliteninstabilität) werden als G4 klassifiziert.
70% aller Adenokarzinome sind G2!
| Differenzierung | % tubuläre Differenzierung | 2-stufiges Grading n. AJCC | |
| G1 | gut differenziert | > 95 % | low grade |
| G2 | mäßig differenziert | 50 – 95 % | low grade |
| G3 | schlecht differenziert | 5 -50 % | high grade |
| G4 | undifferenziert | < 5 % | high grade |
Lit.: WHO 2000
Das „Grading“ dient der Prognoseabschätzung von GIST hinsichtlich ihres biologischen Verhaltens. Ein eigentliches Grading entsprechend G1 bis G4 ist nicht definiert.
Das biologische Verhalten wird anhand der Tumorgröße, der Mitoseanzahl abgeschätzt.
| Größe | Mitosen auf 50 HPF | Metastasierungsrisiko |
| < 2cm | keine | sehr gring |
| 2 -5 cm | < 5 | gering |
| < 5 cm | 6 -10 | mittel |
| 5 -10 cm | < 5 | mittel |
| > 5 cm | > 5 | hoch |
| > 10 cm | egal | hoch |
| egal | > 10 | hoch |
NIH-Guidelines
modifiziert (korrigiert) nach Damjanow und Fan 2007
Die totale Mesorektumentfernung (TME) stellt eine chirurgische Maßnahme zur Verringerung des Rezidivrisikos von Rektumkarzinomen dar. Sie erfolgt entlang einer Faszie an der Mesorektumoberfläche, die möglichst nicht zerstört werden soll. Die Vollständigkeit der TME soll im Rahmen der makroskopischen Untersuchung beurteilt werden (S3-Leitlinie Kolorektale Karzinome)
Graduierung anhand der M.E.R.C.U.R.Y.-Studie:
| Grad 1 |
|
| Grad 2 |
|
|
Grad 3 |
|
Magen
Adenokarzinom des Magens
Das Grading der gastralen Adenokarzinome ist in Kombination mit der Laurén-Klassifikation assoziiert mit der Prognose und gibt dem Operateur Hinweise auf die notwendige Radikalität der Operation.
Das Grading der Adenokarzinome des Magens ist v.a. abhängig vom glandulären Differenzierungsgrad.
Laurén-Klassifikation:
-
Intestinaler Typ
-
Diffuser Typ
-
Mischtyp
| Grad | Differenzierung | Histologie |
| G1 | gut differenziert | gut ausgebildete Drüsen oder Papillen aus resorptiven Epithelien oder Becherzellen |
| G2 | mäßig differenziert | unregelmäßig verzweigte Drüsen, komplexes Wachstumsmuster oder unvollständige Papillen |
| G3 | schlecht differenziert | schlecht ausgebildete Drüsen, Einzelzellinfiltration |
| G4 | undifferenziert | konventionell-histologisch keine erkennbarekonventionell histologisch keine erkennbare Differenzierung |
modifiziert nach Damjanow und Fan 2007
Ösophagus
Ösophagus: Plattenepithelkarzinom
Das Grading plattenepithelialer Karzinome des Ösophagus gilt als Prognosefaktor.
Das Grading der ösophagealen Plattenepithelkarzinome setzt sich zusammen aus dem Vorhandensein bzw. Fehlen plattenepithelialer Eigenschaften im Vergleich zum normalen Plattenepithel.
| Grad | Differenzierung | Ähnlichkeit zum normalen Epithel | Hornperlen | Vorherrschende Zellpopulation | Interzellular-brücken |
| G1 | gut differenziert | hoch | häufig | reif plattenepithelial | deutlich |
| G2 | mäßig differenziert | noch erkennbar | selten oder keine | mehr basaloid, teilweise reif plattenepithelial | fokal erhalten |
| G3 | schlecht differenziert | kaum erkennbar | keine |
undifferenziert |
selten oder keine |
Kopf/Hals
Kopf/Hals/Speicheldrüsen/olfaktorische Neuroblastome
Kopf/Hals: Plattenepithelkarzinome
Das Grading plattenepithelialer Karzinome ist auch im Kopf-Hals-Bereich als prognostischer Marker zu werten. Obwohl der histologische Differenzierungsgrad mit der Prognose positiv korreliert, sind Tumorgröße und Nodalstatus die bedeutenderen prognostischen Faktoren.
| G1 | G2 | G3 | |
| Invasionsfront | abgerundet oder ausgefranst | abgerundet oder ausgefranst | ausgefranst, plump invasiv |
| Größe der Tumornester | variabel | variabel | variabel, aber oft klein und mit Einzelzellen |
| Verhornung der Zellen und Interzellularbrücken | prominent | fast immer vorhanden, aber weniger prominent | minimal oder fehlend |
| Hornperlen | oft | oft | selten |
| Mitosen | wenige | mäßig häufig | häufig, atypisch |
| Gefäßinvasion | selten | manchmal | häufig |
| (WHO 2005) |
Speicheldrüsen: adenoid-zystische Karzinome
Das Grading der adenoid-zystischen Karzinome ist nach WHO nicht eindeutig definiert. Je nach Wachstumsmuster soll jedoch eine bessere oder schlechtere Prognose assoziiert sein.
Nach WHO ist ein Grading nicht eindeutig definiert. Es wird jeweils der prozentuale Anteil der soliden Tumorkomponente angegeben:
-
- Unter 30% solider Anteil: tubulo-trabekulärer Subtyp (beste Prognose) bzw. glandulär-kribriformer Subtyp
-
- Über 30% solider Anteil: solider Subtyp (schlechtere Prognose)
Nach Damjanow und Fan (2007) wird das Wachstumsmuster als wegweisendes Kriterium für ein Grading genannt (s. Tabelle)
|
Speicheldrüsen: mukoepidermoide Karzinome
Das Grading der mukoepidermoiden Karzinome dient als prognostsicher Marker und wird anhand eines Scores bestimmt:
|
(nach WHO 2005)
Eine schlechtere Prognose wird für G3-Karzinome in den kleinen Speicheldrüsen und der Glandula parotis angegeben; dies gilt nicht für die Glandula submandibularis.
Grading olfaktorischer Neuroblastome nach Hyams
Das Hyams-Grading ist das am häufigsten verwendete Gradingsystem für diese seltene Tumorentität.
| I | II | III | IV* | |
| Lobuläres Wachstumsmuster | ++ | ++ | +/- | - |
| Kernpleomorphie | - | -/+ | + | ++ |
| Mitosen | - | -/+ | + | ++ |
| Kalzifikationen | +/- | +/- | - | - |
| Nekrosen/Apoptosen | - | - | +/- | ++ |
| Neurofibrillärer Hintergrund | ++ | + | +/- | - |
| HW-Pseudorosetten oder FW-Rosetten** | +/++ | +/- | -/+ | - |
(nach Damjanow und Fan 2007 sowie WHO 2005)
Speicheldrüsen: Adenokarzinome (NOS)
Das Grading der Adenokarzinome der Speicheldrüsen, NOS, dient als prognostischer Marker.
Das Grading dieser Karzinome wird neben der Kernpleomorphie, der mitotischen Aktivität und dem Vorhandensein oder Fehlen von Nekrosen v.a. durch die duktulo-glanduläre Differenzierung bestimmt.
| G1 | G2 | G3 | |
| Kernpleomorphie | gering | mäßig (Nukleolen sichtbar) | deutlich (Hyperchromasie) |
| Mitosen | selten | häufiger | sehr häufig |
| Nekrosen | fehlen | manchmal | immer |
| Duktulo-glanduläre Differenzierung | prominent | vorhanden, aber auch solide Tumoranteile vorhanden | selten bis fehlend |
(nach Damjanow und Fan 2007 sowie WHO 2005)
Staging
TNM-Klassifikation
Aufgabe
Maligne Tumoren werden soweit wie möglich entsprechend der TNM-Klassifikation klassifiziert. Die klinische und pathohistologische TNM-Klassifikationen eines Tumors sind eng mit der Prognose korreliert und bestimmen prä-, intra- und postoperativ die Therapie.
Durchführung
Die Tumoren werden entsprechend der TNM-Klassifikation der IUCC graduiert. Grundlage ist ab 1.1.2003 die gültige 6. Auflage der TNM-Klassifikation.
Die TNM-Klassifikation steht am Ende des Befundes als formelhafte Zusammenfassung. Folgende Reihenfolge ist bei uns verbindlich:
-
Morphologieschlüssel (siehe „Typing“),
-
Grading (siehe „Grading“),
-
T-Klassifikation,
-
N-Klassifikation mit LKM-Quotient,
-
M-Klassifikation,
-
L-Klassifkation (siehe L-Klass.),
-
V-Klassifikation (siehe V-Klass.),
-
R-Klassifikation (siehe R-Klass.),
-
evtl. S-Klassifikation (siehe S-Klass.).
-
Die Angabe von C-Faktoren (siehe C-Faktor) ist fakultativ.
Eine möglichst vollständige Klassifikation wird bei jedem Tumorpräparat durchgeführt. Bei mehreren Präparaten (Tumorbiopsie, Nachresektat, Lymphknotenexstirpation) erfolgt in unserer bei jedem Befund die Klassifikation. Bei absehbarem Folgematerial wird die Tumorklassifikation als “Vorläufige Tumorklassifikation” bezeichnet, im letzten Befund wird die Tumorklassifikation als “Abschließende Tumorklassifikation unter Berücksichtigung der Vorbefunde” bezeichnet.
In der Tumorklassifikation werden bei allen großen OP-Präparaten auch die fakultativen Deskriptoren aufgeführt. Bei kleineren Proben und Biopsien werden die fakultativen Deskriptoren im Falle eines positiven Befundes (z.B. vorhandene Lymphangiosis) aufgeführt.
Zweifelhafte Klassifikationen werden in der Praxis diskutiert.
Beispiel:
Tumorklassifikation: M8500/3 G2 pT3 pN1a (2/22) MX L0 V0 R0
Anmerkung:
Eine wichtige Funktion der Tumorklassifikationen ist deren Zusammenführung in Krebsregistern zur epidemiologischen datenbankgestützten Auswertung. Deshalb ist eine einheitliche Anwendung der Notation nötig. Die Verwendung von römischen Ziffern und die Notation durch tiefgestellte Indizes ist bei den oben aufgeführten Parametern nicht vorgesehen, die Groß- und Kleinschreibung der Buchstaben sollte verbindlich gehandhabt werden (MX statt Mx).
L-Klassifikation
Die Untersuchung und Dokumentation von Lymphgefäßeinbrüchen sollte bei Karzinomen immer erfolgen, auch wenn die L-Klassifikation nur ein fakultativer Deskriptor ist. Er korreliert mit der nodalen Metastasierung, der Gefahr eines Lokalrezidivs und mit der Prognose.
Es bedeuten:
-
LX : Lymphgefäßinvasion kann nicht bestimmt werden.
-
L0 : Keine Lymphgefäßinvasion
-
L1 : Lymphgefäßinvasion vorhanden
Die Klassifikation beruht auf der konventionell-histologischen Untersuchung. Immunhistochemische Zusatzuntersuchungen (Endotheldarstellung) sind nur bei Vorliegen besonderer Umstände (z.B. fragliche Lymphangiosis bei pN0 oder Lymphangiosis in der Nähe des Resektionsrandes) notwendig. Bei ausgeprägten fixationsbedingten Schrumpfspaltenbildungen in einem Tumor kann eine Lymphangiosis nur eingeschränkt erkannt werden und die Gefahr falsch positiver oder falsch negativer Ergebnisse ist groß. Es soll dann nach LX klassifiziert werden.
Beim Mammakarzinom wird grundsätzlich nur die extratumorale Lymphangiosis carcinomatosa bewertet.
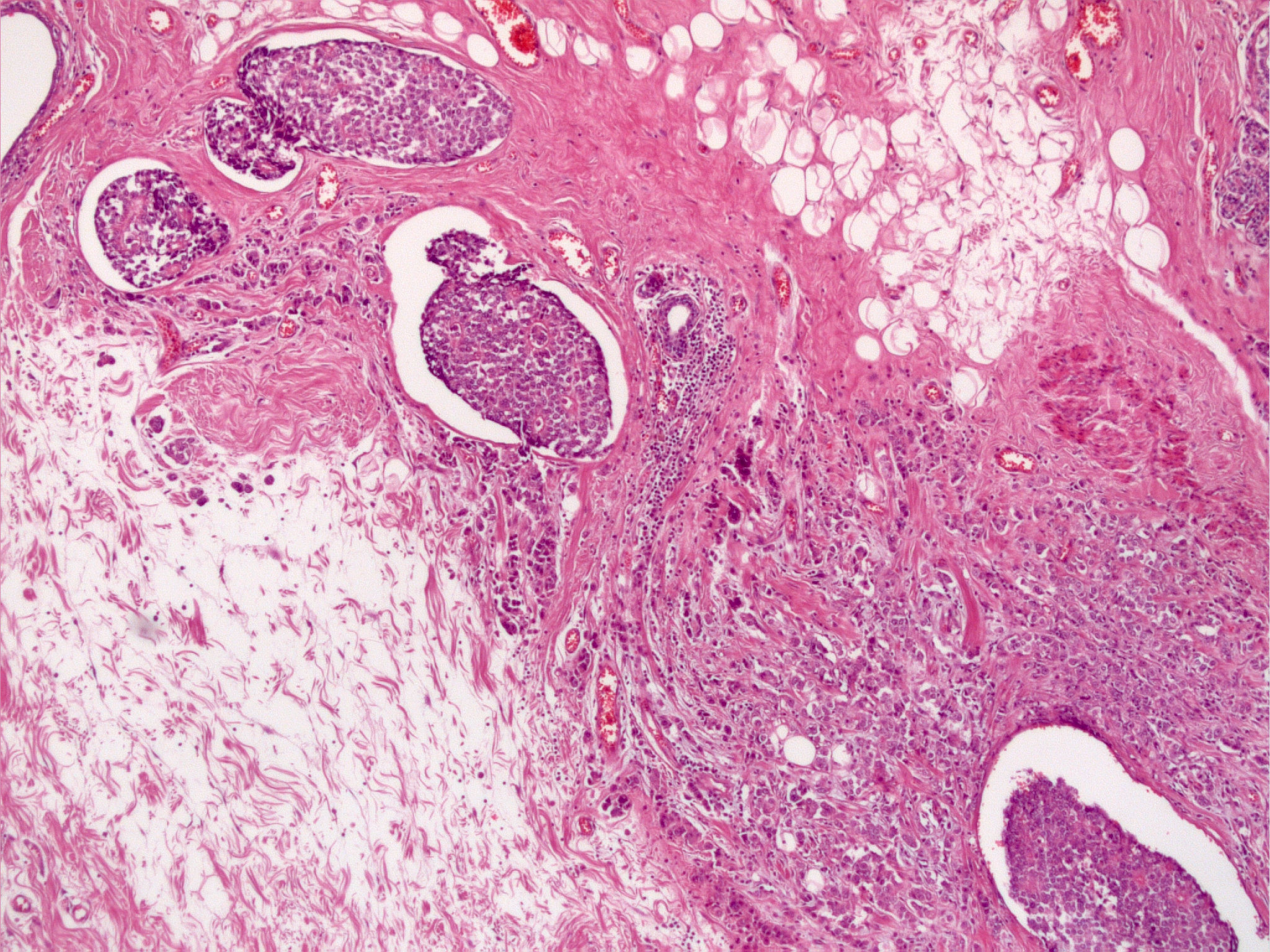 Lymphangiosis in einem Mammakarzinom |
V-Klassifikation
Die Untersuchung und Dokumentation von Blutgefäßeinbrüchen sollte bei Karzinomen und Sarkomen immer erfolgen, auch wenn die V-Klassifikation nur ein fakultativer Deskriptor ist. Er korreliert mit der Fernmetastasierung und entsprechend mit einer schlechteren Prognose.
Es bedeuten:
-
VX : Blutgefäßinvasion kann nicht bestimmt werden.
-
V0 : Keine Blutgefäßinvasion
-
V1 : Mikroskopische Blutgefäßinvasion vorhanden
-
V2 : Makroskopische Blutgefäßinvasion vorhanden
Die Klassifikation beruht auf der konventionell-histologischen Untersuchung. Zur Abgrenzung gegen eine Lymphgefäßinvasion kann eine EvG-Färbung und oder eine Endothel-Darstellung nötig sein. Mit Hilfe von Lymphendothel-spezifischen Markern ist diese Differenzierung auch mittlerweile immunhistologisch möglich.
Der Nachweis von Blutgefäßeinbrüchen beeinflusst bei manchen Entitäten die pT-Klassifikation.
R-Klassifikation
Die Untersuchung und Dokumentation der Vollständigkeit der Resektion von Karzinomen und Sarkomen gehört zu den zentralen Aufgaben der Untersuchung durch den Pathologen. Jedes onkologisches Präparat sollte eine Aussage zum Residualstatus enthalten (Zuschnitt und Methodik). Die R-Klassifikation beschreibt das Fehlen oder Vorhandensein von Resttumor. Auch wenn die R-Klassifikation kein obligater Deskriptor der TNM-Klassifikation, wird wegen der überragenden Bedeutung für die Prognose eine generelle Angabe bei der Klassifikation empfohlen.
Es bedeuten:
-
RX : Vorhandensein von Residualtumor kann nicht bestimmt werden.
-
R0 : Kein Residualtumor
-
R1 : Mikroskopischer Residualtumor
-
R2 : Makroskopischer Residualtumor
Die Klassifikation beruht auf der konventionell-histologischen Untersuchung und der klinischen Angabe von verbliebenem Tumor (entweder als Primärtumor oder als Metastase). Die R-Klassifikation hat nicht die primäre Funktion, den Erfolg des chirurgischen Eingriffs zu bewerten, sondern soll Patienten mit guter und schlechter Prognose trennen. Ein lokal in toto entfernter Tumor mit manifesten Metastasen ist ein Stadium R2.
S-Klassifikation
in Kürze verfügbar!
C-Faktor
in Kürze verfügbar!
Kolonkarzinom
Weitere Stratifizierung des T-Stadiums bei kolorektalen Karzinomen.
Zur verbesserten Prognosebestimmung wird das Stadium pT1 und pT3 beim kolorektalen weiter stratifiziert.
Das Stadium pT1 wird anhand der Tiefe der Infiltration in der Submukosa wie folgt aufgeteilt:
-
pT1 (sm1): Infiltration auf das luminale Drittel der Submukosa beschränkt.
-
pT1 (sm2): Infiltration bis in das mittlere Drittel der Submukosa.
-
pT1 (sm3): Infiltration bis in das äußere Drittel der Submukosa.
Das Stadium pT3 wird anhand der Tiefeninfiltration in das perikolische Fettgewebe wie folgt aufgeteilt:
-
pT3a: < 1 mm Infiltration des perikolischen Fettgewebes.
-
pT3b: 1 bis <4 mm Infiltration des perikolischen Fettgewebes.
-
pT3c: 4 -15 mm Infiltration des perikolischen Fettgewebes.
-
pT3d: > 15 mm Infiltration des perikolischen Fettgewebes.
Melanom
Eindringtiefe eines malignen Melanoms (Clark-Level)
Die verschiedenen Clark Level werden durch die Infiltrationstiefe des malignen Melanoms in die Haut definiert.
Es werden folgende Invasionslevel beschrieben:
-
Clark Level I: Tumorzellen nur in der Epidermis („Melanoma in situ“) – entspricht: pTis
-
Clark Level II: Tumorzellen durchbrechen die Basalmembran und infiltrieren in das Stratum papillare der Dermis.
-
Clark Level III: Tumorzellen füllen das Stratum papillare stellenweise voll aus und buchten das Stratum reticulare fokal nach unten aus.
-
Clark Level IV: Tumorzellen infiltrieren das Stratum reticulare.
-
Clark Level V: Tumorzellen infiltrieren das subkutane Fettgewebe.
Maximale Tumordicke eines malignen Melanoms (Breslow-Index)
Die Tumordicke eines malignen Melanoms wird als prognostischer Marker angesehen. Sie geht in die TNM-Klassifikation im Rahmen des T-Stadiums ein. Die vertikale Tumordicke des malignen Melanoms wird mittels Okularmikrometer ausgemessen und wird definiert als die Dicke zwischen Stratum granulosum der Epidermis oder, bei ulzerierten Tumoren, von der Tumoroberfläche bis zur tiefstgelegenen Tumorzelle.
-
bis 1mm: 95% tumorspezifische 10-JÜLR
-
1,01 mm bis 2 mm: 79-84% tumorspezifische 10-JÜLR
-
2,01 mm bis 4mm: 64-73% tumorspezifische 10-JÜLR
-
über 4 mm: 52-54% tumorspezifische 10-JÜLR
Das Vorhandensein einer histologisch erkennbaren Ulzeration führt gemäß der neuen AJCC-Klassifikation zur Höhergruppierung in das nächsthöhere Stadium.
Therapie
Therapie-relevante Klassifikationen
Regressionsgrading nach neoadjuvanter oder adjuvanter Therapie:
Mammakarzinom
Regressionsgrading von Mammakarzinomen nach neoadjuvanter Chemotherapie
Mammakarzinome können zum sog. „Down-Stagen“ neoadjuvant behandelt werden. Dem Pathologen fällt die Aufgabe zu, den Therapieerfolg zu quantifizieren.
Die Quantifizierung des Therapieerfolges kann in einem 5-stufigen Score nach Sinn et.al. (1993) erfolgen:
-
· 0 = kein Effekt
-
· 1 = Sklerose und zytopathische Effekte
-
· 2 = minimaler invasiver Tumorrest (< 0,5 cm)
-
· 3 = kein invasiver Resttumor
-
· 4 = tumorfrei
Dieses Regressionsgrading ist bislang nicht prospektiv validiert worden.
Sinn HP et al. (1993): Histologische Regression des Mammakarzinoms nach neoadjuvanter Chemotherapie. Verh. Dtsch. Ges. Path. 77: 577
Prostatakarzinom
Regressionsgrading bei Prostatakarzinomen
Das Regressionsgrading beinhaltet die Beurteilung des Zytoplasmas, der Kerne und des Stromas:
Morphologische Befunde an Prostatakarzinomen nach Hormon- und Strahlentherapie
-
Zytoplasma: grobe Vakuolisierung, hydropische Schwellung und Ballonierung, Ruptur der Zellmembran
-
Kerne: Vergrößerung, Chromatinverklumpung, bizarre Formen, Nukleolenschwellung bis –schwund, Pyknose
-
Stroma: Fibroblastenproliferation, Sklerosierung, Hyalinisierung, Muskelfaserdegeneration
-
Tumorfreie Drüsen: Atrophie des sekretorischen Epithels, Plattenepithelmetaplasien, Kernatypien nach Bestrahlung
Histologisches Regressionsgrading
| Punkte | Morphologische Charakteristika | Regressions-grad | Bewertung |
| 10 | Keine Regression | I | Keine oder geringe Regression |
| 8 | Noch große Tumorausbreitung, nur fokale Regression mit Vakuolisierung, geringe Kernpyknose, noch Nukleoli | ||
| 6 | Ansteigende Regression in allen Tumoranteilen bei noch breiter Ausdehnung | II | Mäßiggradige Regression |
| 4 | Wenige Tumornester mit deutlicher Regression, Kernpyknose ohne Nukleoli | ||
| 2 | Wenige winzige Verbände von Zellen, kaum mehr als Tumorzellen identifizierbar | III | Starke Regression |
| 0 | Kein Tumor mehr nachweisbar | X | Kein Tumor nachweisbar |
Lit.: Helpap B (1998): Prognosefaktoren des Prostatakarzinoms. Pathologe 19:42-52
Kolonkarzinom
Regressionsgrading beim Kolon- und Rektumkarzinom nach neoadjuvanter Therapie
Kolonkarzinome können zum sog. „Down-Stagen“ neoadjuvant behandelt werden. Dem Pathologen fällt die Aufgabe zu, den Therapieerfolg zu quantifizieren.
Die Quantifizierung des Therapieerfolges erfolgt in einem 3-stufigen Grading nach der Japanese Society for Cancer of the Colon and Rectum (JSCCR 1997):
-
Grad 0 = kein Effekt: weder Nekrose noch zelluläre oder strukturelle Veränderungen nachweisbar.
-
Grad 1 = geringe Regression
-
Grad 1 a = Nekrose oder Verschwinden des Tumors in weniger als 1/3 der Läsion oder nur zellulärer oder strukturelle Veränderungen.
-
Grad 1 b = Nekrose oder Verschwinden des Tumors in weniger als 2/3 der Läsion, aber vitaler Tumor noch vorhanden.
-
-
Grad 2 = mäßiggradige Regression: Nekrose oder Verschwinden des Tumors in mehr als 2/3 der Läsion, aber vitaler Tumor noch vorhanden.
-
Grad 3 = starke Regression: gesamte Läsion nekrotisch und/oder durch Fibrose mit oder ohne granulomatöse Reaktion ersetzt, keine vitalen Tumorzellen.
MALT-Lymphom
Graduierung morphologischer Auswirkungen einer Chemotherapie auf ein MALT-Lymphom (GELA-Grading)
Das GELA-Grading beschreibt den Grad des Ansprechens eines MALT-Lymphoms auf eine Chemotherapie.
Für die Graduierung werden das Auftreten lymphoider Infiltrate, das Vorhandensein lymphoepithelialer Läsionen und evtl. Stromaveränderungen beurteilt.
| Score | lymphoide Infiltrate | lymphoepitheliale Läsionen | Stroma-veränderungen |
| Komplettremission(CR) | keine oder locker angeordnete Plasmazellen und reife Lymphozyten in der Lamina propria | keine | entzündungszellfreie Lamina propria und/oder Fibrose |
| wahrscheinlich minimale Residuen(pMRD) | lymphoide Aggregate oder Lymphozytenherde in der Lamina propria/Muscularis mucosae und/oder Submukosa | keine | entzündungszellfreie Lamina propria und/oder Fibrose |
| teilweises Ansprechen auf Therapie(rRD) | dichtes diffuses oder noduläres Lymphozyteninfiltrat um Drüsen in der Lamina propria | fokal | fokal entzündungszellfreie Lamina propria und/oder Fibrose |
| keine Veränderungen(NC) | dichtes diffuses oder noduläres Lymphozyteninfiltrat | vorhanden, gelegentlich keine | keine Veränderungen |
-
CR: complete histological remission
-
pMRD: probable minimal residual disease
-
rRD: responding residual disease
-
NC: nor changes
Hormonrezeptoren:
IRS
Quantifizierung des Hormonrezeptorgehalts
 In Deutschland wird der Östrogen- und Progesteronrezeptorgehalt bei Mammakarzinomen quantifiziert.
In Deutschland wird der Östrogen- und Progesteronrezeptorgehalt bei Mammakarzinomen quantifiziert.
Hormonrezeptoren werden mit Hilfe eines Multikations-Score aus Färbeintensität und Anteil positiver Zellen quantifiziert (Remmele und Stegner 1987). Es werden nur nukleäre Signale gewertet. Das Ergebnis ist der immunreaktive Score (IRS).
| Score | Färbeintensität | Anteil positiver Zellen (alle Intensitäten) |
| 0 | Keine Färbereaktion | 0 % |
| 1 | Schwache Färbereaktion | < 10 % |
| 2 | Mäßig starke Färbereaktion | 10 % – 50 % |
| 3 | Starke Färbereaktion | 51 % – 80 % |
| 4 | - | > 80 % |
Berechnung: IRS = Score(Färbeintensität) x Score(Anteil positiver Zellen)
Der IRS nimmt einen Wert zwischen 0 und 12 an und wird wie folgt interpretiert:
| IRS | Interpretation |
| 0 bis 1 | Rezeptor-negativ |
| 2 bis 3 | Rezeptor-positiv, schwache Expression (siehe Anmerkung) |
| 4 bis 8 | Rezeptor-positiv, mäßig starke Expression |
| 9 bis 12 | Rezeptor-positiv, starke Expression |
Anmerkung: Aus der Angabe des IRS lässt sich die die Indikation für eine antihormonelle Therapie nicht eindeutig ableiten. Derzeitig werden Patientinnen behandelt, die mindestens 10% Rezeptor-positive Zellkerne aufweisen, sodass sich unter den Score-Werten 2 und 3 sowohl Karzinome mit als auch ohne antihormonelle Behandlungsindikation befinden.
Lit.: Remmele und Stegner (1987): Pathologe 8:138-140
H-Score
H Score zur alternativen Quantifizierung der Hormonrezeptoren
Alternative Quantifizierung der Hormonrezeptoren beim Mammakarzinom.
Bei Anwendung des H-Scores werden die Prozentsätze der einzelnen Färbeintensitätsstufen ermittelt und das Ergebnis als Summe der Produkte (Prozentsatz * Intensitätsstufe) angegeben.
| % Zellen mit schwacher Färbung x 1+ | Höchst-Score: 300 0 – 50 negativ 51 – 100 schwach positiv101 – 200 mäßig positiv201 – 300 stark positiv |
| % Zellen mit mittlerer Färbung x 2+ | |
| % Zellen mit starker Färbung x 3 |
Der H Score wird nur im Bedarfsfall (explizite Nachfrage des Einsenders oder des behandelnden Arztes) angegeben.
Quick-score
Quick Score zur alternativen Quantifizierung der Hormonrezeptoren beim Mammakarzinom
Alternative Quantifizierung der Hormonrezeptoren beim Mammakarzinom
Der Quick Score ist ein Summenscore aus Anzahl gefärbter Zellen und Färbeintensität (jeweils als Klassen)
| Quick Score | |||
| Anzahl positiver Zellen | Intensität | ||
| Keine Färbung | 0 | ||
| <1 % | 1 | Schwach | 1 |
| 1 – 10 % | 2 | Mittel | 2 |
| 11 – 33 % | 3 | Stark | 3 |
| 34 – 66 % | 4 | ||
| 67 – 100 % | 5 | ||
| Die Summe ergibt maximal einen Scorewert von 8. | |||
| Interpretation: | |
| Score 0 – 1 | Eine endokrine Therapie ist ohne Effekt. |
| Score 2 – 3 | Geringe (20 %) Chance für therapeutisches Ansprechen |
| Score 4 – 6 | Mäßige (50 %) Chance für therapeutisches Ansprechen |
| Score 7 – 8 | Gute (75 %) Chance für therapeutisches Ansprechen |
Der Quick Score wird nur auf ausdrücklichen Wunsch des Einsenders oder des behandelnden Arztes angegeben.
Weitere Klassifikationen:
HER2/neu
Auswertung des Hercept-Tests
Die Auswertung des Hercept-Tests bei invasiven Mammakarzinomen muss streng entsprechend der Testanweisung erfolgen. Das Ergebnis des Test wird als Score mitgeteilt. Es bedeuten:
| Score | HER2- Überexpression |
Färbemuster |
| 0 | negativ | Keine Färbung oder Färbung in weniger als 10 % der Tumorzellen |
| 1+ | negativ | partielle membranständige Färbung in mehr als 10% der Tumorzellen mit schwacher Färbeintensität |
| 2+ | positiv *) | komplette membranständige Färbung in mehr als 10% der Tumorzellen mit schwacher bis mäßig starker Färbeintensität |
| 3+ | positiv | komplette membranständige Färbung in mehr als 10% (Originalprotokoll) bzw. 30 % (aktuelle Empfehlung S3-Leitlinien und ASCO) der Tumorzellen mit schwacher bis mäßig starker Färbeintensität |
*) Eine Behandlungsindikation ist nur dann gegeben, wenn zusätzlich eine Amplifikation des Her2/neu-kodierenden Gens c-erbB2 nachgewiesen ist.
EGFR
EGF-Rezeptor
Der EGF-Rezeptor kann als therapeutisches Target bei EGF-Rezeptor-exprimierenden Tumoren verwendet werden. Der EGF-Rezeptor wird immunhistologisch mit dem EGFR pharmDx-Kit von DakoCytomation dargestellt und ausgewertet.
Auswertung nach Kit-Anleitung:
| Mitteilung an den behandelnden Arzt | Definition | |
| EGFR-negativ | Ausbleiben einer spezifischen Membranfärbung innerhalb des Tumors | |
| EGFR-positiv | Als positive (1+) Färbung werden alle IHC-Färbungen der Zellmembran des Tumors bezeichnet, die stärker sind als die Hintergrundfärbung, egal ob es sich um eine komplette, inkomplette oder um eine periphere Färbung handelt | |
| Färbungsintensität | Prozentsatz der gefärbten Tumorzellen | |
| 1+, 2+ oder 3+ | >= 1% | |
Nottingham-PI
Nottingham-Prognose-Index invasiver Mammakarzinome
Invasive Mammakarzinome werden anhand der Tumorgröße, des Gradings und des Nodalstatus in Form eines gewichteten Summenscores graduiert. Die S3-Leitlinie Mammakarzinome legt die Angabe des Prognose-Index als optional fest. Sofern er explizit vom Einsender gefordert wird, erfolgt eine Bestimmung durch den befundenden Pathologen. Die Bestimmung des Prognose-Index kann bei allen invasiven Mammakarzinomen erfolgen.
| Merkmale | Kriterien | Scorewerte | |
| Grading (Elston/Ellis) | G1G2G3 | 123 | |
| Lymphknotenstatus | pN01-3 LK positiv≥?4 LK positiv | 123 | |
| Indexwert = Größe [cm] x 0,2 + Score(Grading) + Score(LK-Status) | |||
| Indexwert | Prognose | 15-Jahresüberlebensrate | |
| 3,43,41 – 5,40> 5,40 | GutIntermediärSchlecht | 80 %42 %13 % | |
Lit.:
-
Elston CW and Ellis IO (1991): Pathological prognostic factors in breast cancer. I. The value of histological grade in breast cancer: experience from a large study with long-term follow-up. Histopathology 19:403-410
-
Galea MH,Blamey RW, Elston CE, Ellis IO (1992): he NottinghamPrognostic Index in primary breast cancer. Breast Cancer Res Treat. 22:207-219
B-Klassifikation
Klassifikation von Veränderungen an Stanzbiopsien der Mamma (B-Klassifikation nach NHSBSP)
Stanzbioptisch diagnostizierte Veränderungen werden zur Vereinfachung der Dokumentation entspechend der so genannten B-Klassifikation in Klassen gruppiert.
Es bedeuten:
| Code | Bedeutung | Erläuterung |
| B1-a | Nicht verwertbar | |
| B1-b | Ausschließlich Normalgewebe |
|
| B2 | Benigne |
|
| B3 | Benigne, aber mit unsicherem biologischem Potential |
|
| B4 | Malignitätsverdächtig |
|
| B5 | Maligne |
|
Lit.: E.C. working group on breast screening pathology und National Coordinating Group Breast sreening Pathology (NHSBSP): guidelines for non-operative diagnostic procedures and reporting in breast cancer:
http://www.cancerscreening.nhs.uk/breastscreen/publications/qa-08.html
Van Nuys PI
Van Nuys-Prognose-Index
Der Van-Nuys-Index wurde bis vor wenigen Jahren beim duktalen Carcinoma in situ (DCIS) zur Prognoseabschätzung und zur Planung therapeutischer Maßnahmen angewandt. Der Index wird aus einem jeweils dreistufigen Score für histologischen Malignitätsgrad, Größe der DCIS-Läsion und Abstand der DCIS-Läsion zu den Resektionsrändern ermittelt. Der Wert liegt zwischen 3 und 9.
Für die Ermittlung des Van-Nuys-Index wird folgendes Schema angewandt: Dieser Score ist nicht Bestandteil der S3-Leitlinie Mammakarzinom. Vorrangig ist die Entfernung des DCIS mit ausreichendem Sicherheitsabstand (0,5 cm).
| Score 1 | Score 2 | Score 3 | |
| Größe des DCIS | <= 15 mm | 16 – 40 mm | >= 41 mm |
| Minimale Distanz zu den Resektionsrändern | <= 10 mm | 1 – 9 mm | < 1 mm |
| Histologische DCIS Klassifikation | Non-High Grade (Kerngrading 1 und 2 ) ohne Nekrosen | Non-High Grade (Kerngrading 1 und 2 ) mit Nekrosen | High Grade (Kerngrading 3) |
Therapieempfehlung (derzeit nicht leitlinienkonform!):
|
|||
Lit.: Silverstein MJ, Lagios MD, Craig PH, Waisman JR, Lewinsky BS, Colburn WJ, Poller DN (1996) A prognostic index for ductal carcinoma in situ of the breast. Cancer 77:2267-2274
Entzündung
Klassifikationen spezieller Entzündungen
Hepatitis
Virus-Hepatitis-Score
Die histopathologischen Veränderungen bei chronischer Hepatitis B und C graduieren die entzündliche Aktivität (Grading) und das Stadium der Fibrose (Staging).
Der Virus-Hepatitis-Score wird an Gewebeproben der Leber (Biopsien, Keilexzisionen, Organexplantaten) von Patienten mit chronischer Infektion von Hepatitis B und C bestimmt.
| Merkmale | Kriterien | Scorewerte |
| Grad der entzündlichen Aktivität | Keine entzündliche Aktivität: Lockere Rundzellinfiltration* der Portalfelder ohne Übergriff auf das Leberläppchen/keine Rundzellen im Leberläppchen | 0 |
| Minimale entzündliche Aktivität: Kleinherdiger Übergriff der Rundzellinfiltrate in einzelnen Portalfeldern auf das Läppchen (”Mottenfraßnekrosen”) und/oder einzelne/wenige Rundzellen im Leberläppchen mit wenigen hepatozellulären Nekrosen | 1 | |
| Milde entzündliche Aktivität: in zahlreichen Portalfeldern Übergriff der Rundzellen auf das Läppchen und/oder einzelne/wenige Rundzellen im Leberläppchen mit wenigen hepatozellulären Nekrosen | 2 | |
| Moderate entzündliche Aktivität: In allen Portalfeldern Übergriff der Rundzellen auf die Läppchen und/oder zahlreiche Rundzellen im Leberläppchen mit deutlich erkennbaren hepatozellulären Nekrosen | 3 | |
| Schwere entzündliche Aktivität: In allen Portalfeldern langstreckiger Übergriff der Rundzellen auf die Läppchen unter Ausbildung von porto-zentralen oder porto-portalen Brückenekrosen und/oder dichte Rundzellinfiltrate in den Läppchen mit ausgedehnten hepatozellulären Nekrosen | 4 | |
| Stadium der Fibrose | Keine Fibrose | 0 |
| Portale Fibrose: bindegewebige portaleVerbreiterung | 1 | |
| Periportale Fibrose: schmale Bindegewebsausläufer in das Läppchen, fokal porto-portale Bindegewebssepten | 2 | |
| Septenbildende Firbose: porto-portale und porto-zentrale Fibrosen ohne Regeneratknoten | 3 | |
| Komplette Leberzirrhose: brückenbildende porto-portale und porto-zentrale Fibrosen und Bildung von Regeneratknoten | 4 |
* Rundzellen = Lymphozyten, Plasmazellen
Lit.: Batts KP, Ludwig J (1995) Chronic hepatitis. An update on terminology and reporting. Am J Surg Pathol 19:1409-1417
Vaskulitis
Vaskulitis-Klassifikation
Vaskulitiden werden entsprechend der „Chapel Hill Consensus Conference“ (1994) eingeteilt.
Vaskulitis-Klassifikation gemäß der „Chapel Hill Consensus Conference“ (1994)
| Vaskulitis großer Gefäße |
| Riesenzellarteriitis |
| Takayasu-Arteriitis |
| Vaskulitis mittelgroßer Gefäße |
| Polyarteriitis nodosa |
| Kawasaki-Erkrankung |
| Vaskulitis kleiner Gefäße |
| Wegenersche Granulomatose |
| Churg-Strauss Syndrom |
| Mikroskopische Polyangiitis |
| Henoch-Schönlein Purpura |
| Essenzielle Kryoglobulinämie |
| Kutane leukozytoklastische Angiitis |
Lit.: Jennette JC, Falk RJ, Andrassy K, Bacon PA, Churg J, Gross WL, Hagen EC, Hoffman GS, Hunder GG, Kallenberg CG, et al. (1994) Nomenclature of systemic vasculitides: Proposal of an international consensus conference. Arthritis Rheum 37:187-192
Zöliakie
Modifizierte Marsh-Klassifikation im Rahmen der Zöliakie-Diagnostik
Im Rahmen der bioptischen Zöliakiediagnostik werden Veränderungen des Dünndarms entsprechend der Marsh-Klassifikation klassifiziert.
Es bedeuten:
| Marsh-Typ | Bedeutung | Erläuterung | |||
| IEL/100 Epithelien | Krypten | Zotten | |||
| 0 | Normalbefund | < 25 | Normal | Normal | |
| I | infiltrativer Typ | > 25 | Normal | Normal | |
| II | hyperplastischer Typ | > 25 | Hyperplasie | Normal | |
| III | a | destruktiver Typ, milde Zottenatrophie | > 25 | Hyperplasie | Leichte/mäßige Atrophie |
| b | destruktiver Typ, hochgradige Zottenatrophie | > 25 | Hyperplasie | Subtotale Atrophie | |
| c | destruktiver Typ, totale Zottenatrophie | > 25 | Hyperplasie | Totale Atrophie | |
| IV | hypoplastischer Typ | < 25 | Normal | Totale Atrophie | |
Lit.: Oberhuber, G. et al. (2001): Empfehlungen zur Zöliakie-/Spruediagnostik. Pathologe 22: 72-81
Synovialitis
Graduierung der chronischen Synovialitis anhand des Synovialitis-Scores
Bei einem größeren Anteil der Gelenkerkrankungen ist die histopathologische Diagnostik dadurch eingeschränkt, dass nur uncharakteristische Befunde zu erheben sind. Für diese Fälle wurde ein Graduierungssystem, der sog. Synovialitis-Score, erstellt, der die immunologischen Vorgänge in der Syovialmembran berücksichtigt, um die Synovialitisdiagnostik zu standardisieren und um die Wertigkeit der histopathologischen Diagnostik zu erhöhen.
Graduierung der 3 Kompartimente der chronischen Synovialitis anhand des Synovialitis-Scores
| Verbreiterung der synovialen Deckzellschicht | |
| 0 Punkte | nur eine Zellage breit |
| 1 Punkt | 2 oder 3 Zellagen breit |
| 2 Punkte | 4 oder 5 Zellagen breit |
| 3 Punkte | Mehr al 5 Zellagen breit, ggf. multinukleäre Riesenzellen und Palisadenbildung oder Ulzeration mit Fibrinexsudation |
| Zelldichte des synovialen Stromas | |
| 0 Punkte | normale Zelldichte |
| 1 Punkt | gering erhöhte Zelldichte |
| 2 Punkte | mittelgradig erhöhte Zelldichte, ggf. vereinzelt multinukleäre Riesenzellen |
| 3 Punkte | hohe Zelldichte, multinukleäre Riesenzellen, evtl. rheumatoide Granulome |
| Leukozytäre entzündliche Infiltration | |
| 0 Punkte | Kein enzündliches Infiltrat |
| 1 Punkt | Einzelne meist perivaskulär gelegene Lymphozyten oder Plasmazellen und kleine Lymphozytenaggregate |
| 2 Punkte | Größere Lymphozytenaggregate |
| 3 Punkte | Dichtes konfluentes lymphozytäres Infiltrat oder Lymphfollikel mit Keimzentren |
| Bewertung | |
| Summe 0 bis 1 | Keine Synovialitis |
| Summe 2 bis 4 | Geringgradige Synovialitis |
| Summe 5 bis 9 | Hochgradige Synovialitis |
Lit.: Krenn V et al. Differenzialdiagnostik der chronischen Synovialitis. Pathologe 27: 402-408 (2006)
Gelenkdestr.
Graduierung der chronischen Synovialitis anhand des Synovialitis-Scores
Bei einem größeren Anteil der Gelenkerkrankungen ist die histopathologische Diagnostik dadurch eingeschränkt, dass nur uncharakteristische Befunde zu erheben sind. Für diese Fälle wurde ein Graduierungssystem, der sog. Synovialitis-Score, erstellt, der die immunologischen Vorgänge in der Syovialmembran berücksichtigt, um die Synovialitisdiagnostik zu standardisieren und um die Wertigkeit der histopathologischen Diagnostik zu erhöhen.
Graduierung der 3 Kompartimente der chronischen Synovialitis anhand des Synovialitis-Scores:
| Grad | Histologische Kennzeichen |
| 0 | Normal |
| I | Oberflächliche Fibrillierung, kein Substanzverlust |
| II | Knorpeldefekt, der nicht die gesamte Dicke des Knorpels umfasst (Substanzdefekte, Risse, Fibrillierung erreichen den subchondralen Knochen) |
| III | Knorpeldefekt, der die gesamte Dicke des Knorpels umfasst (tiefreichende Substanzdefekte, Risse, Fibrillierung erreichen den subchondralen Knochen) |
| IV | Vollständiger Knorpelverlust (zumindest fokal) |
Literatur: Otte P. Die konservative Behandlung der Hüft- und Kniearthrose und ihre Gefahren. Dtsch Med Jahresschr 20: 604-609 (1969)
Graduierung der Gelenksdestruktion nach Mankin.
Der Begriff „Graduierung“ definiert das lokale Schädigungsausmaß der Gelenkdestruktion. Er bezieht sich auf verschiedene Lokalisationen im Gelenk und erfasst nicht die Integrität des Gelenkes als ganzes.
Das Graduierungssystem nach Mankin ist das mit Abstand am meisten angewandte. Die Graduierung erfolgt anhand der Beurteilung von der Struktur des Knorpels, der Chondrozyten, der Intensität der Safranin-O-Färbung zur Markierung des Regeneratknorpels und des Tidemarks.
Grading der Gelenkdestruktion nach Mankin et al.
| Kriterium | Grad | Histologische Kennzeichen |
| Struktur des Knorpels | 0 | Normal |
| 1 | Oberflächenunregelmäßigkeiten | |
| 2 | Pannus und Oberflächenunregelmäßigkeiten | |
| 3 | Risse in der Übergangszone | |
| 4 | Risse bis in die tiefe Zone | |
| 5 | Risse bis in die kalzifizierte Zone | |
| Chondrozyten | 0 | Normal |
| 1 | Diffuse Hyperzellularität | |
| 2 | Zellklone | |
| 3 | Hypozellularität | |
| Safranin-O-Färbung | 0 | Normal |
| 1 | Leicht reduzierte Anfärbung | |
| 2 | Mäßig reduzierte Anfärbung | |
| 3 | Stark reduzierte Anfärbung | |
| 4 | Keine Anfärbung | |
| 5 | Totale Desorganisation (eher bei Regeneratknorpel) | |
| Tidemark | 0 | Intakt |
| 1 | Von Gefäßen durchbrochen |
Score:
-
Mankin 0 bis 2: normal
-
Mankin 3 bis 5: entspricht Grad I nach Otte
-
Mankin 6 bis 7: osteoathrotisch, entspricht Grad II nach Otte
-
Mankin 8 bis 10: entspricht Grad III nach Otte
-
Mankin über 10: entspricht Grad IV nach Otte
Lit.: Mankin HJ, et al. Biochemical and metabolic abnormalities in articular cartilage from osteoarthritic human hips. J Bone Joint Surg Am 53: 523-537 (1971)
Allgemeine und sonstige Klassifikationen
Body-Mass-Index
Zur objektiven Abschätzung von Über- und Untergewichtigkeit dient der Body-Mass-Index.Der Body-Mass-Index errechnet sich wie folgt:
BMI = Gewicht in Kilogramm (kg) / Körpergröße (m)2.
Er wird für Frauen und Männer gleichermaßen angewendet.
Es gilt:
| Body-Mass-Index | Bewertung | |
| < 16 | Kritisches Untergewicht | |
| < 17,5 | Diagnostisches Kriterium für Anorexia nervosa | |
| < 18,5 | Untergewicht | |
| 18,5 – <25 | Normalgewicht | |
| 25 – <30 | Grad I | Übergewicht |
| 30 – <40 | Grad II | Adipositas |
| > 40 | Grad III | Adipositas permagna |
Ein durch Muskelaufbau erhöhter BMI ist nicht als Übergewicht zu werten.
HNPCC
HNPCC-Syndrom
Der Pathologe hat eine zunehmend wichtiger werdende Aufgabe, anhand histologischer Merkmale und anamnestischer Daten bei der Erkennung heriditärer Krebserkankungen mitzuwirken.
Amsterdam-Kriterien I
-
Mindestens 3 Familienmitglieder mit kolorektalem Karzinom
-
Mindestens 2 aufeinander folgende Generationen betroffen
-
Ein Familienmitglied erstgradig verwandt mit den beiden anderen
-
Ein Erkrankter zum Zeitpunkt der Erstdiagnose jünger als 50 Jahre
-
Ausschluss einer familiären adenomatösen Polypose (FAP)
Amsterdam-Kriterien II (modifiziertes erstes Kriterium)
-
Mindestens 3 Familienmitglieder mit kolorektalem Karzinom und/oder Endometrium-, Dünndarm- oder urothelialem Karzinom von Nierenbecken oder Ureter
-
Übrige Kriterien wie oben
Histopathologische Merkmale von Karzinomen i. R. eines HNPCC-Syndroms
-
Muzinöses Karzinom des proximalen Kolons
-
Medulläres Karzinom
-
Karzinom mit ausgeprägter intratumoröser Lymphozyteninfiltration
-
Karzinom mit ausgeprägten intratumorösen Lymphozytenaggregaten
-
Mikrosatelliteninstabilität, insbesondere hohen Grades (MSI-H)
Bei Vorliegen dieser Kriterien sollte die Möglichkeit eines HNPCC geäußert werden.
Organgewicht
Normgewichtstabellen innerer Organe
Die pathologisch-anatomische Diagnose stellt eine zusammenfassende Beurteilung und Wertung der krankhaften Befunde dar. Diese beinhaltet in der makroskopischen Befundung die Beurteilung und Wertung der Abweichungen von Organgewichten und deren Maße von der Norm.
Wichtige normale Organgewichte und Maße
| Herz (g) | Leber (g) | Milz (g) | Nieren (g) | Gehirn (g) | |
| Reifes Neugeborenes | 21 -24 | 120 – 140 | 10 – 12 | 23 – 25 | 360 – 390 |
| Erwachsener | 260 – 350 | 1500 – 1700 | 120 – 160 | 250 – 300 | 1200 – 1400 |
| Greis | 290 – 360 | 1200 – 1500 | 90 – 120 | 220 – 260 | 1100 – 1300 |
Herz: Das Herzgewicht steht zum Körpergewicht in einem Verhältnis von 1:200 (5 ‰ des gesamten Körpergewichtes in kg).
Dicke der Ventrikelmuskulatur bei Erwachsenen:
-
Linker Ventrikel (2 cm unterhalb des Ansatzes der Mitralis gemessen): 12-15 mm
-
Rechter Ventrikel (2 cm unterhalb der Pulmonalis gemessen): 25 mm
Ostienumfang bei Erwachsenen:
-
Mitralis 9-10 cm
-
Trikuspidalis: 10-12 cm
-
Aorta: 5,5-7,5 cm
-
Pulmonalis: 6,5-7,5 cm.
Weitere Organgewichte beim Erwachsenen:
-
Lungen: re. 350-550 g, li. 325-450 g
-
Pankreas: 8090 g
-
Nebennieren: 12,514 g
-
Schilddrüse: 30 g
-
Hypophyse: 0,60,8 g
-
Thymus: Reifes Neugeborenes: 7-14 g, 1-10 Jahre: 10-25 g, 11-15 Jahre: 20-25 g.
Fertilität
Johnsen-Score
Für die Bewertung des Fertilitätsgrades an Hodenbiopsien hat sich der Johnsen-Score bewährt.
Es werden 50 Tubulus-Querschnitte ausgezählt und entsprechend Klassen in der Tabelle bewertet:
| Score 1 | Epithelfreie Tubuli |
| Score 2 | Keine Samenzellen, nur Sertoli-Zellen |
| Score 3 | Nur Spermatogonien |
| Score 4 | Weniger als 5 Spermatozyten pro Tubulus |
| Score 5 | Keine Spermatiden, nur Spermatozyten |
| Score 6 | Weniger als 10 Spermatiden pro Tubulus |
| Score 7 | Keine Spermien, nur Spermatiden |
| Score 8 | Weniger als 10 Spermien pro Tubulus |
| Score 9 | Desquamation/Desorganisation |
| Score 10 | Regelrechte Spermiogenese |
Das ausschlaggebende Entscheidungskriterium bei dieser Methode ist die Anzahl der am weitesten entwickelten Samenzellen in einem Tubulus. Von diesen 50 bildet man das arithmetische Mittel und erhält ein Ergebnis, das für den gesamten Hoden repräsentativ ist. In den USA werden für die Beurteilung der Fertilität lediglich drei Bewertungsgruppen verwendet:
-
Johnsen-Score 1-6: massive Reifungsstörung
-
Johnsen-Score 6-8: leichtere Reifungsstörung
-
Johnsen-Score 8-10: weitgehend normale Spermatogenese
HPV-Typen
in Kürze verfügbar!

