Nachfolgend wird der Arbeitsablauf dargestellt und ein paar typische Probleme beleuchtet. Der Weg vom Biopsat oder OP-Präparat bis zum fertigen Befund ist arbeits- und zeitintensiv. Wenn man von der Schnellschnittdiagnostik absieht, dauert die Aufarbeitung der Präparate vom Eingang beim Pathologen bis zum fertigen Befund mindestens vom Nachmittag eines Tages bis zum Vormittag des folgenden Tages. Diese Zeitvorgabe lässt sich bei Cito-Anforderungen einhalten. Stärkere Verzögerungen ergeben sich meist aus dem Postversand der Präparate vom Einsender zum Pathologen und des Befundes vom Pathologen zum Einsender. Die Bearbeitungszeit beim Pathologen wird durch mehrere aufeinander folgende Bearbeitungsschritte geprägt, die teilweise arbeitsintensiv und nicht automatisierbar sind. Die Einbettungsprozedur erfolgt über Nacht und bedingt, dass die Bearbeitung frühestens am nächsten Tag abgeschlossen werden kann. In den meisten Fällen macht die Bearbeitungszeit beim Pathologen aber nur einen geringen Anteil an der Zeitspanne zwischen Probenentnahme und Eintreffen des Befundes aus.
 Nach der Probenentnahme wird das Material mit einem Begleitschein vom einsendenden Arzt verschickt. Dem Material wird vom einsendenden Arzt ein Begleitschein begelegt, aus dem die Patientendaten und Angaben zum Material hervorgehen, insbesondere die Lokalisation, Seitenangabe, Angaben zu Markierungen und die Fragestellung.
Nach der Probenentnahme wird das Material mit einem Begleitschein vom einsendenden Arzt verschickt. Dem Material wird vom einsendenden Arzt ein Begleitschein begelegt, aus dem die Patientendaten und Angaben zum Material hervorgehen, insbesondere die Lokalisation, Seitenangabe, Angaben zu Markierungen und die Fragestellung.
Jedem Patientenmaterial wird eine Bearbeitungsnummer (Eingangsnummer) zugeordnet. Die Eingangsnummer bildet während der Bearbeitung und der Archivierung die Klammer, die
-
die Patientendaten,
-
die Materialzuordnung in den verschiedenen Bearbeitungsstufen (Nassmaterial, Paraffinmaterial und Schnitte) und
-
die Vorbefunde in der Datenbank zusammenhält.
 Die Erfassung der Patientendaten erfolgt teils manuell und wird durch ein Texterkennungsprogramm assistiert, das die Einsende- bzw. Überweisungsscheine scannt, im Hintergrund die Daten erkennt, auf Konsistenz prüft und eine Zuordung zu eventuell bereits vorhandenen Datensätzen des Patienten vorschlägt.
Die Erfassung der Patientendaten erfolgt teils manuell und wird durch ein Texterkennungsprogramm assistiert, das die Einsende- bzw. Überweisungsscheine scannt, im Hintergrund die Daten erkennt, auf Konsistenz prüft und eine Zuordung zu eventuell bereits vorhandenen Datensätzen des Patienten vorschlägt.
Durch Barcode-Etiketten wird der schnelle Zugang des bearbeitenden Arztes zu den Vorbefunden sicher gestellt.
Das fixierte Gewebe wird zunächst makroskopisch untersucht. Dabei werden die Größe und evtl. das Gewicht bestimmt. Größere Präparate werden in Scheiben aufgeschnitten (auflamelliert) oder anatomisch präpariert. Alle mit dem bloßen Auge erkennbaren Veränderungen werden dabei beschrieben. Sein besonderes Augenmerk richtet der Pathologe dabei auf den Abstand einer Veränderung zum Resektionsrand. Der Pathologe muss beurteilen, ob eine Veränderung (z.B. gut- oder bösartiger Tumor) vollständig entfernt wurde oder ob die Läsion in den Resektionsrand reicht und somit wahrscheinlich nicht vollständig entfernt wurde. Hier kann dann eine Nachoperation nötig sein. Es gibt auch Situationen, in denen der Pathologe die Beziehung einer Läsion zum Resektionsrand nicht eindeutig beurteilen kann.
Größere Präparate werden in Scheiben aufgeschnitten (auflamelliert) oder anatomisch präpariert. Alle mit dem bloßen Auge erkennbaren Veränderungen werden dabei beschrieben. Sein besonderes Augenmerk richtet der Pathologe dabei auf den Abstand einer Veränderung zum Resektionsrand. Der Pathologe muss beurteilen, ob eine Veränderung (z.B. gut- oder bösartiger Tumor) vollständig entfernt wurde oder ob die Läsion in den Resektionsrand reicht und somit wahrscheinlich nicht vollständig entfernt wurde. Hier kann dann eine Nachoperation nötig sein. Es gibt auch Situationen, in denen der Pathologe die Beziehung einer Läsion zum Resektionsrand nicht eindeutig beurteilen kann.
Beurteilung des Resektionsrandes
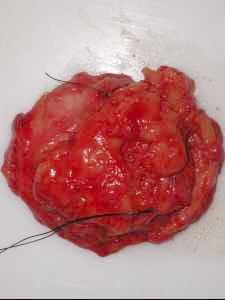 Damit so zielgenau und so Gewebe sparend wie möglich nachreseziert werden kann, ist es notwendig, dass die Präparate durch den Operateur markiert werden. Hierdurch wird es möglich, die Präparate dreidimensional (z. B. bei Mamma-PEs) oder zweidimensional (z.B. bei Hautresektaten) zu orientieren. Darüber hinaus erleichtert (!) die Markierung eines Präparates die genaue Beschreibung eines Präparates. Die Präparatemarkierungen müssen eindeutig den Hauptachsen (kranial-kaudal, medial-lateral, ventral-dorsal) zugeordnet werden. Insbesondere bei dreidimensional zu orientierenden Präparaten sollten die Bezeichnungen nach Uhrzeiten vermieden werden. Ein zweidimensional zu orientierendes Präparat bedarf mindestens einer Markierung, ein dreidimensionales Präparat braucht für die eindeutige Orientierung mindestens zwei Markierungen auf unterschiedlichen Achsen und die Seitenangabe.
Damit so zielgenau und so Gewebe sparend wie möglich nachreseziert werden kann, ist es notwendig, dass die Präparate durch den Operateur markiert werden. Hierdurch wird es möglich, die Präparate dreidimensional (z. B. bei Mamma-PEs) oder zweidimensional (z.B. bei Hautresektaten) zu orientieren. Darüber hinaus erleichtert (!) die Markierung eines Präparates die genaue Beschreibung eines Präparates. Die Präparatemarkierungen müssen eindeutig den Hauptachsen (kranial-kaudal, medial-lateral, ventral-dorsal) zugeordnet werden. Insbesondere bei dreidimensional zu orientierenden Präparaten sollten die Bezeichnungen nach Uhrzeiten vermieden werden. Ein zweidimensional zu orientierendes Präparat bedarf mindestens einer Markierung, ein dreidimensionales Präparat braucht für die eindeutige Orientierung mindestens zwei Markierungen auf unterschiedlichen Achsen und die Seitenangabe.
Die Markierung erfolgt meist durch Nahtfäden, wobei in erster Linie die Fadenlänge und die Fadenanzahl zur Unterscheidung herangezogen werden sollte. Die Farbe des Fadens sollte eher unberücksichtigt bleiben. Bei komplexen Präparaten (z.B. aus der Kiefer- und Gesichtchirurgie und dem HNO-Bereich) mit vielen anatomisch zu bezeichnenden Rändern ist es sinnvoll, das Präparat auf eine Korkplatte aufzuspannen und die Resektionsränder mit farbigen Nadeln zu markieren. Nadeln haben gegenüber Nahtfäden den Vorteil, dass sie für die Präparation leichter entfernt werden können und die Reste des Präparates danach wieder anatomisch korrekt zusammengefügt werden können.
Um den Resektionsrand im histologischen Schnitt eindeutig identifizieren zu können, gibt es verschiedene Tricks. Dieses ist wichtig, um evtl. anschnittbedingte Schnittkanten von den wahren Resektionsrändern zu differenzieren. Häufig sind die Resektionsränder durch Blutauflagerungen oder thermische Koagulationsartefakte des Elektrokauters erkennbar, eindeutiger ist aber eine flächenhafte Markierung durch Substanzen, die im Schnitt identifizierbar sind. Am gebräuchlichsten ist Tusche, deren kolloidale Farbpigmente sich leicht identifizieren lassen und im Schnitt auch mehrere verschiedenfar
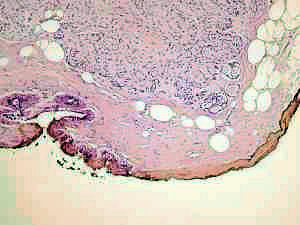 bige Markierungen möglich machen. Ein großer Nachteil der Tuschemarkierung ist, dass sie kaum trocknet und so verlaufen kann. Wenn dabei die Oberfläche von Schnittflächen mit Tusche kontaminiert wird und der Paraffinblock nicht vollständig angeschnitten wird, kann ein positiver Schnittrand vorgetäuscht werden. In anderen Instituten wird deshalb TippEx zur Markierung genutzt, weil es schneller trocknet. Wir nutzen Silbernitrat (Höllenstein) zur Markierung, das mit einem Stift auf die Präparateoberfläche aufgemalt wird. Anschließend wird das Silber als Chlorid mit Kochsalzlösung ausgefällt (bei dieser Gelegenheit: viele Grüße an meinen ehemaligen Chemielehrer Herrn Kühl, Thema: Lösungsmittelprodukt und Chloridgruppe
bige Markierungen möglich machen. Ein großer Nachteil der Tuschemarkierung ist, dass sie kaum trocknet und so verlaufen kann. Wenn dabei die Oberfläche von Schnittflächen mit Tusche kontaminiert wird und der Paraffinblock nicht vollständig angeschnitten wird, kann ein positiver Schnittrand vorgetäuscht werden. In anderen Instituten wird deshalb TippEx zur Markierung genutzt, weil es schneller trocknet. Wir nutzen Silbernitrat (Höllenstein) zur Markierung, das mit einem Stift auf die Präparateoberfläche aufgemalt wird. Anschließend wird das Silber als Chlorid mit Kochsalzlösung ausgefällt (bei dieser Gelegenheit: viele Grüße an meinen ehemaligen Chemielehrer Herrn Kühl, Thema: Lösungsmittelprodukt und Chloridgruppe ![]() ).und ist im Schnitt als schwarzer Saum an der Oberfläche erkennbar. Bei Gewebe, das in Phosphat gepuffertem Formalin fixiert wurde, fällt das Silber als Silberphosphat aus. Dieses hat eine fahlgelbe Eigenfarbe. Diese Art der Markierung ist absolut wischfest. Die unvermeidlichen, schwer entfernbaren Silberflecken auf der Arbeitsfläche kann man mit Farmerschem Abschwächer (Fotofachhandel) entfernen. Als weitere Methode ist die Markierung mit Eisenpartikeln vorgeschlagen worden.
).und ist im Schnitt als schwarzer Saum an der Oberfläche erkennbar. Bei Gewebe, das in Phosphat gepuffertem Formalin fixiert wurde, fällt das Silber als Silberphosphat aus. Dieses hat eine fahlgelbe Eigenfarbe. Diese Art der Markierung ist absolut wischfest. Die unvermeidlichen, schwer entfernbaren Silberflecken auf der Arbeitsfläche kann man mit Farmerschem Abschwächer (Fotofachhandel) entfernen. Als weitere Methode ist die Markierung mit Eisenpartikeln vorgeschlagen worden.
Die zugeschnittenen Gewebeproben und Biopsate werden in Einbettungskassetten verschlossen. Schlitze oder Löcher im Boden und im Deckel der Kassette erlauben den freien Zugang der Lösungsmittel zur Gewebsprobe. Kleine Biopsate können zusätzlich zwischen Papier in der Kassette gehalten werden.
Längliche Stanzzylinder (z.B. Leber, Mamma und Prostata) werden zwischen zwei Schaumstoffkissen in einer gestreckten Form weiterbehandelt, um später die Zylinder plan einbetten und optimal anschneiden zu können. Das Bild zeigt drei Prostatastanzen in ihren Kapseln. Für die Paraffinhistologie muss das Gewebe entwässert und entfettet werden, erst dann lässt sich das Gewebe mit Paraffin durchtränken und wird für die Histologie schneidbar.
Der Einbettungsprozess erfolgt i.d.R. über Nacht. Die eingekapselten Gewebeproben werden dabei durch mehrere Bäder mit Alkohol geführt und dabei entwässert. Durch Proteinausfällung im Alkohol wird das Gewebe gleichzeitig gehärtet. Je nach verwendetem Alkohol wird das Material zusätzlich entfettet. Wenn Ethanol verwendet wird, muss das Gewebe anschließend mit Xylol entfettet werden. Dieses Lösungsmittel vermittelt schließlich die Immersion des Paraffins in das Gewebe. Alternativ kann auf Ethylalkohol und das Xylol verzichtet werden, wenn eine kombinierte Entwässerung und Entfettung mit Isopropanol durchgeführt wird. Aus dem Isopropanol kann man direkt in das Paraffin gehen. Alternative Einbettverfahren nutzen Azeton als Einbettungsmedium oder beschleunigen den Einbettvorgang durch eine Mikrowellen-assistierte Entwässerung.
 Anschließend werden die Gewebe eingeblockt. Die 60°C warmen Gewebsproben werden in kleine wannenförmige Gießformen gesetzt und die Form mit Paraffin aufgefüllt. Die Einbettkassette wird als Träger aufgesetzt. Wenn das Paraffin erkaltet ist, kann man den Block aus der Form nehmen. Das Gewebe hat jetzt eine weitgehend gleichmäßige Härte und kann geschnitten werden.
Anschließend werden die Gewebe eingeblockt. Die 60°C warmen Gewebsproben werden in kleine wannenförmige Gießformen gesetzt und die Form mit Paraffin aufgefüllt. Die Einbettkassette wird als Träger aufgesetzt. Wenn das Paraffin erkaltet ist, kann man den Block aus der Form nehmen. Das Gewebe hat jetzt eine weitgehend gleichmäßige Härte und kann geschnitten werden.
Mikrotomieren
Für die histologische Untersuchung muss das Paraffin eingebettete Gewebe in hauchdünne Scheiben geschnitten werden. Nur so kann man mit der Durchlichtmikroskopie ein scharfes und überlagerungsfreies Bild erhalten. Die Dicke der Schnitte beträgt nur ca. 2 bis 5 Mikrometer (µm), d.h. 2 bis 5 Tausendstel Millimeter. Zum Vergleich: ein Kopfhaar hat einen Durchmesser von ungefähr 20 µm, ein rotes Blutkörperchen hat einen Durchmesser von 7 µm und das Darmbakterium Escherichia coli hat eine Länge von ungefähr 1 µm. Eine geringe Schnittdicke erleichert die Beurteilung subzellulärer Strukturen, wie z.B. die des Kernchromatins. Die Schnitte werden von den medizinisch-technischen Assistentinnen an speziellen Schneideapparaten, den Mikrotomen hergestellt. Der Paraffinblock wird zunächst auf -20°C oder -35°C heruntergekühlt, damit die Härte zunimmt. Der gekühlte Paraffinblock wird dann fest in das Mikrotom eingespannt. Über den Block wird dann ein Messer, das auf einem Schlitten gelagert ist, geführt, so dass zunächst eine plane Schnittfläche entsteht. Anschließend werden die Schnitte für die Histologie geschnitten, wobei das Paraffinblöckchen bei jeden Schnitt durch eine entsprechende Mechanik um die Schnittdicke angehoben wird. Wenn man mehrere Schnitte hintereinander ausführt, bilden die einzelnen Schnitte eine Kette aufeinander folgenden Schnittstufen (Serienschnitte). Wenn man zwischen einzelnen Schnittstufen Material verwirft, um einen Gewebsblock in der ganzen Breite aufzuarbeiten, spricht man von Stufenschnitten.


Die Schnitte falten sich beim Schneiden in unterschiedlichem Ausmaß auf und müssen deshalb zunächst gesteckt werden. Dazu werden sie in ein erwärmtes Wasserbad, dem Streckbad überführt. Hier schwimmen die Paraffinschnitte an der Wasseroberfläche und werden durch die Oberflächenspannung des Wassers plan ”gezogen”. Die Schnitte werden dann auf Glasobjektträger aufgezogen. Das zwischen Glas und dem Schnitt eingeschlossene Wasser wird in einem Wärmeschrank entfernt. Der Paraffinschnitt haftet dann durch elektrostatische Wechselwirkungen direkt am Glas.
 |
 |
 |
Bessere Ergebnisse lassen sich nach unseren Erfahrungen mit einem Rotationsmikrotom. Das Messer steht hierbei fest und der Paraffinblock wird mit Hilfe einer Kurbelmechanik am Messer vorbeigeführt. Man erreicht dünnere, gleichmäßigere und damit besser beurteilbare Schnitte. Außerdem ist die Verletzungsgefahr bauartbedingt am Rotationsmikrotom geringer als am Schlittenmikrotom. Wir haben mittlerweile alle Schneidearbeitsplätze auf Rotationsmikrotome umgestellt.
Die Schnitte sind nach dem Schneiden immer noch mit Paraffin durchtränkt und weitgehend durchsichtig. Die Gewebsstrukturen werden deshalb gefärbt. Dazu wird das Paraffin aus dem Gewebe zunächst ausgescholzen und die Reste mit einem Lösemittel herausgelöst. Anschließend wird das geschnittene Gewebe über eine Alkoholreihe wieder rehydriert und kann dann gefärbt werden.
 In der Routinehistologie hat sich die Hämatoxilin-Eosin-Färbung durchgesetzt. Auf Grund der unterschiedlichen Ladung beider Farbstoffe werden unterschiedliche Strukturen in der Zelle angefärbt. Der blaue Farbstoff Hämatoxilin hat dabei als basischer Farbstoff eine Affinität zu den negativ geladenen Ribonukleinsäuren (DNA und RNA) und färbt deshalb Kerne blau an. Wenn sich im Zytoplasma wegen einer Stoffwechselaktivierung (z.B. bei einer Regeneration) sehr viel RNA enthält, ist das Zytoplasma ebenfalls basophil, d.h. vermehrt blau angefärbt. Die Proteine des Zytoplasmas und das extrazellulär gelegene Kollagen werden durch den sauren Farbstoff Eosin rot angefärbt.
In der Routinehistologie hat sich die Hämatoxilin-Eosin-Färbung durchgesetzt. Auf Grund der unterschiedlichen Ladung beider Farbstoffe werden unterschiedliche Strukturen in der Zelle angefärbt. Der blaue Farbstoff Hämatoxilin hat dabei als basischer Farbstoff eine Affinität zu den negativ geladenen Ribonukleinsäuren (DNA und RNA) und färbt deshalb Kerne blau an. Wenn sich im Zytoplasma wegen einer Stoffwechselaktivierung (z.B. bei einer Regeneration) sehr viel RNA enthält, ist das Zytoplasma ebenfalls basophil, d.h. vermehrt blau angefärbt. Die Proteine des Zytoplasmas und das extrazellulär gelegene Kollagen werden durch den sauren Farbstoff Eosin rot angefärbt.
 Es gibt eine Reihe von weiteren Färbungen, die spezielle Gewebseigenschaften darstellen.
Es gibt eine Reihe von weiteren Färbungen, die spezielle Gewebseigenschaften darstellen.
Nach der Färbung werden die Schnitte über eine aufsteigende Alkoholreihe wieder entwässert. Anschließend wird der Schnitt mit einem dünnen Deckgläschen, das mit einem Tropfen eines speziellen Harzes aufgeklebt wird, versiegelt und kann so mikroskopisch untersucht und befundet werden. Der Schnitt ist so Jahrzehnte haltbar und wird in dieser Form auch archiviert. Das Färben und Eindeckeln der Präparate erfolgt heutzutage meist automatisiert, die Industrie hat gerade in den letzten Jahren roboter-ähnliche Färbeautomaten entwickelt, die mit einer gewissen Intelligenz ausgestattet sind und durchaus mehrere Färbungen gleichzeitig ausführen.
 Alle am Vortag bearbeiteten Biopsien, Resektate und Zytologien erhält der Pathologe in Präparatemappen geordnet zusammen mit den Einsendescheinen, auf denen klinische Angaben (z.B. Verdachtsdiagnose, bereits durchgeführte Behandlungen usw.) zum Patienten vermerkt sind. Der Pathologe begutachtet die Präparate unter seinem Mikroskop und fasst einen Befundtext ab, der eine Beschreibung der gefundenen Veränderungen, die davon abgeleitete Diagnose der Erkrankungen und einen Kommentar für den behandelnden Arzt (z.B. Empfehlungen für weitere Diagnostik bei unklaren Befunden) enthält. Der Text kann von uns auch direkt in den Computer diktiert und durch automatische Spracherkennung in Text umgewandelt werden.
Alle am Vortag bearbeiteten Biopsien, Resektate und Zytologien erhält der Pathologe in Präparatemappen geordnet zusammen mit den Einsendescheinen, auf denen klinische Angaben (z.B. Verdachtsdiagnose, bereits durchgeführte Behandlungen usw.) zum Patienten vermerkt sind. Der Pathologe begutachtet die Präparate unter seinem Mikroskop und fasst einen Befundtext ab, der eine Beschreibung der gefundenen Veränderungen, die davon abgeleitete Diagnose der Erkrankungen und einen Kommentar für den behandelnden Arzt (z.B. Empfehlungen für weitere Diagnostik bei unklaren Befunden) enthält. Der Text kann von uns auch direkt in den Computer diktiert und durch automatische Spracherkennung in Text umgewandelt werden.
 Der makroskopische und mikroskopische Befund, die Diagnose und die Bewertung werden vom Arzt diktiert und anschließend von einer Sekretärin geschrieben. Der behandelnde Arzt bekommt den schriftlichen Befund in der Regel mit der Post oder einem Kurierdienst. In eiligen Fällen wird der Befund auch gefaxt oder kann telefonisch durch den Arzt aus unserer Datenbank abgefragt werden. Das Datenbanksystem lässt auch eine generelle Versendung der Befunde per Fax zu, sofern der Einsender es wünscht.
Der makroskopische und mikroskopische Befund, die Diagnose und die Bewertung werden vom Arzt diktiert und anschließend von einer Sekretärin geschrieben. Der behandelnde Arzt bekommt den schriftlichen Befund in der Regel mit der Post oder einem Kurierdienst. In eiligen Fällen wird der Befund auch gefaxt oder kann telefonisch durch den Arzt aus unserer Datenbank abgefragt werden. Das Datenbanksystem lässt auch eine generelle Versendung der Befunde per Fax zu, sofern der Einsender es wünscht.

