- Epitheliale Marker
- Blutzellmarker
- Mesenchymale Marker
- Neuroepitheliale Marker:
- Funktionsproteine / Rezeptoren etc.
- p53
- Ki-67-Antigen
Panzytokeratin & Zytokeratin-Fraktionen
Zytokeratine werden von epithelialen Zellen gebildet und repräsentieren als Intermediärfilamente den wichtigsten Teil des Zytoskeletts. Sie sind zytoplasmatisch lokalisiert. Man kennt heute 20 verschiedene Zytokeratine, entsprechend ihrer chemischen Eigenschaften werden sie in saure (Typ A, Zytokeratine 9 bis 20) oder neutral-basische Zytokeratine (Typ B, CK 1 bis 8), entsprechend ihres Molekulargewichtes in hoch- und niedrigmolekulare Zytokeratine eingeteilt. Es gibt eine Reihe von Antikörpern mit einer Spezifität für einzelne Zytokeratine, mehrere Zytokeratine oder Zytokeratingruppen. Im Zytoskelett bildet jeweils ein Typ A-Zytokeratin einen Komplex mit einem Typ B-CK, so dass Epithelien immer mindestens 2 Zytokeratine exprimieren. Die Anzahl kann aber auch deutlich höher sein.
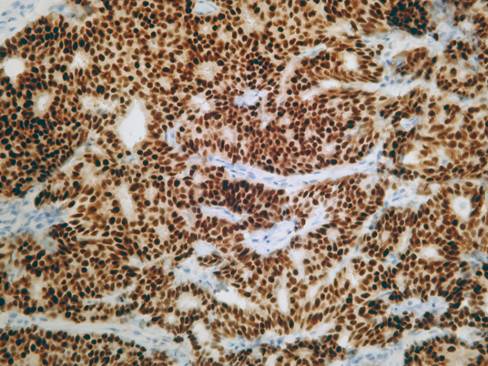
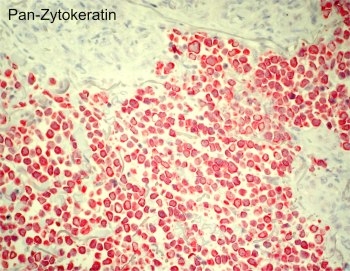 Als Marker für Panzytokeratin bieten sich Antikörper wie KL-1 oder MNF-116, aber auch das Gemisch aus zwei Antikörpern gegen saure und basische Zytokeratine AE1/AE3 an. Die nebenstehende Abbildung zeigt ein schlecht differenziertes Karzinom, das sehr dissolut wächst und sich konventionell-histologisch nicht eindeutig als Karzinom klassifizieren lässt. Das Färbeergebnis beweist aber die epitheliale Histogenese.
Als Marker für Panzytokeratin bieten sich Antikörper wie KL-1 oder MNF-116, aber auch das Gemisch aus zwei Antikörpern gegen saure und basische Zytokeratine AE1/AE3 an. Die nebenstehende Abbildung zeigt ein schlecht differenziertes Karzinom, das sehr dissolut wächst und sich konventionell-histologisch nicht eindeutig als Karzinom klassifizieren lässt. Das Färbeergebnis beweist aber die epitheliale Histogenese.
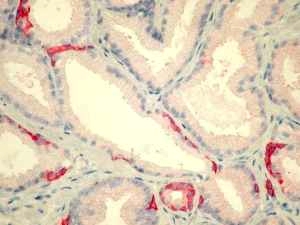 Herausragende Bedeutung bei der Diagnostik des Prostatakarzinoms hat der monoklonale Antikörper 34ßE12, der die hochmolekularen Zytokeratine 5/6/10/14 darstellt. Diese werden in den Basalzellen der Prostata gebildet. Mit Hilfe dieses Antikörpers kann der für das Prostatakarzinom typische Verlust der basalen Zelllage nachgewiesen werden. Andererseits können auch Läsionen, die ein Prostatakarzinom imitieren, vom Prostatakarzinom abgegrenzt werden.
Herausragende Bedeutung bei der Diagnostik des Prostatakarzinoms hat der monoklonale Antikörper 34ßE12, der die hochmolekularen Zytokeratine 5/6/10/14 darstellt. Diese werden in den Basalzellen der Prostata gebildet. Mit Hilfe dieses Antikörpers kann der für das Prostatakarzinom typische Verlust der basalen Zelllage nachgewiesen werden. Andererseits können auch Läsionen, die ein Prostatakarzinom imitieren, vom Prostatakarzinom abgegrenzt werden.
Antikörper gegen einzelne Zytokeratine helfen bei der Klärung der Histogenese eines Tumors. Nicht selten wird ein Tumor erst durch eine Metastase in einem Lymphknoten oder einem inneren Organ auffällig. Durch die immunhistologische Untersuchung des Zytokeratinprofils mit nur wenigen Antikörpern, kann die Primärlokalisation des Tumors häufig eingegrenzt werden, zusammen mit weiteren Tumormarkern ist dabei auch eine definitive Aussage über den Primärtumor möglich. Eine große differentialdiagnostische Rolle haben hierbei insbesondere die Zytokeratine 7, 19 und 20.
Schließlich hat auch der fehlende Nachweis von Zytokeratinen in Karzinomen (z.B. Nebennierenrinde) und manchmal auch das Färbemuster eine diagnostische Bedeutung und kann auf eine bestimmte Histogenese hinweisen (z.B. punktförmiges Muster bei Merkelzellkarzinomen bestimmten Adenohypophysentumoren, Granulosazelltumoren, kleinzelligen Bronchialkarzinomen und Karzinoiden).
Eine Expression von Zytokeratinen liegt auch in bestimmten Sarkomen vor und hat im Zusammenhang mit der konventionellen Histologie und weiteren Immunfärbungen einen hohen diagnostischen Stellenwert. Gefunden wird hier meist eine Expression von CK 8/18/19. Sarkome mit häufiger Zytokeratinexpression sind die synovialen Sarkome, das epitheloide Sarkom und das Chordom. Eine Koexpression von Vimentin und Zytokeratin zeichnet auch das maligne Mesotheliom aus.
Melanommetastasen können in ca. 10 % der Fälle eine aberrante Zytokeratinbildung aufweisen. Diese kann auch in glattmuskulären Tumoren, Rhabdomyosarkomen, Schwannomen, Tumoren der Ewing -Sarkom-Familie und in anaplastisch-großzelligen Lymphomen vorkommen.
Typische Konstellationen sind
-
CK 5 pos., CK 7 neg., CK 13 pos., CK 8/18/19 +/-: Plattenepithelkarzinom
-
CK 7 neg., CK 20 pos.: kolorektale Karzinome (schlecht differenzierte Ca können auch CK 7 exprimieren), Merkelzellkarzinome (typische punktförmige paranukleäre Anfärbung)
-
CK 7 pos., CK 8/18/19 pos., CK 20 neg.: Adenokarzinome der Lunge (TTF-1 pos.), der Mamma (Hormonrezeptoren), des Endometrium (Vimentin, Hormonrezeptoren pos.), nicht-muzinöse Ovarialkarzinome, Mesotheliome (Vimentin pos, Calretinin pos. CEA neg. )
-
CK 7 pos., CK 19 neg., CK 20 neg.: Adenokarzinome der Schilddrüse (TTF-1, Thyreoglobulin jeweils pos.)
-
CK 7 pos., CK 13 pos., CK 20 pos.: Urothelkarzinome
-
CK 7 pos., CK13 neg. CK 20 pos.: Adenokarzinome des Magens, des Pankreas und der Gallenwege, muzinöse Ovarialkarzinome
-
CK 7 neg., CK 20 neg.: Nebennierenrindenkarzinome (meist überhaupt keine CK), hepatozelluläre Karzinome (Hep-Par1 und D11 pos.), Prostatakarzinome (PSA pos.), Nierenzellkarzinome (Vimentin, CD10 pos)
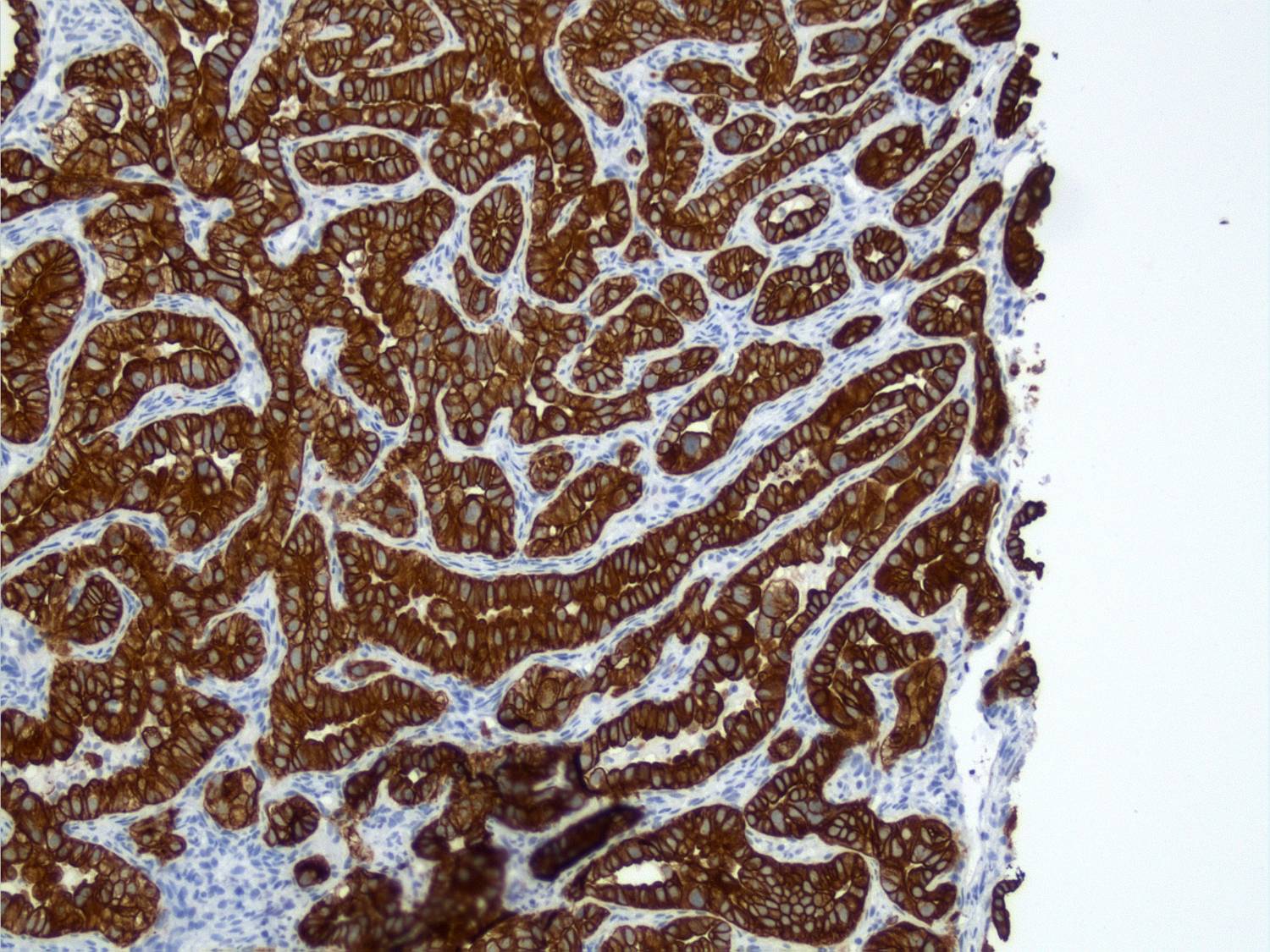
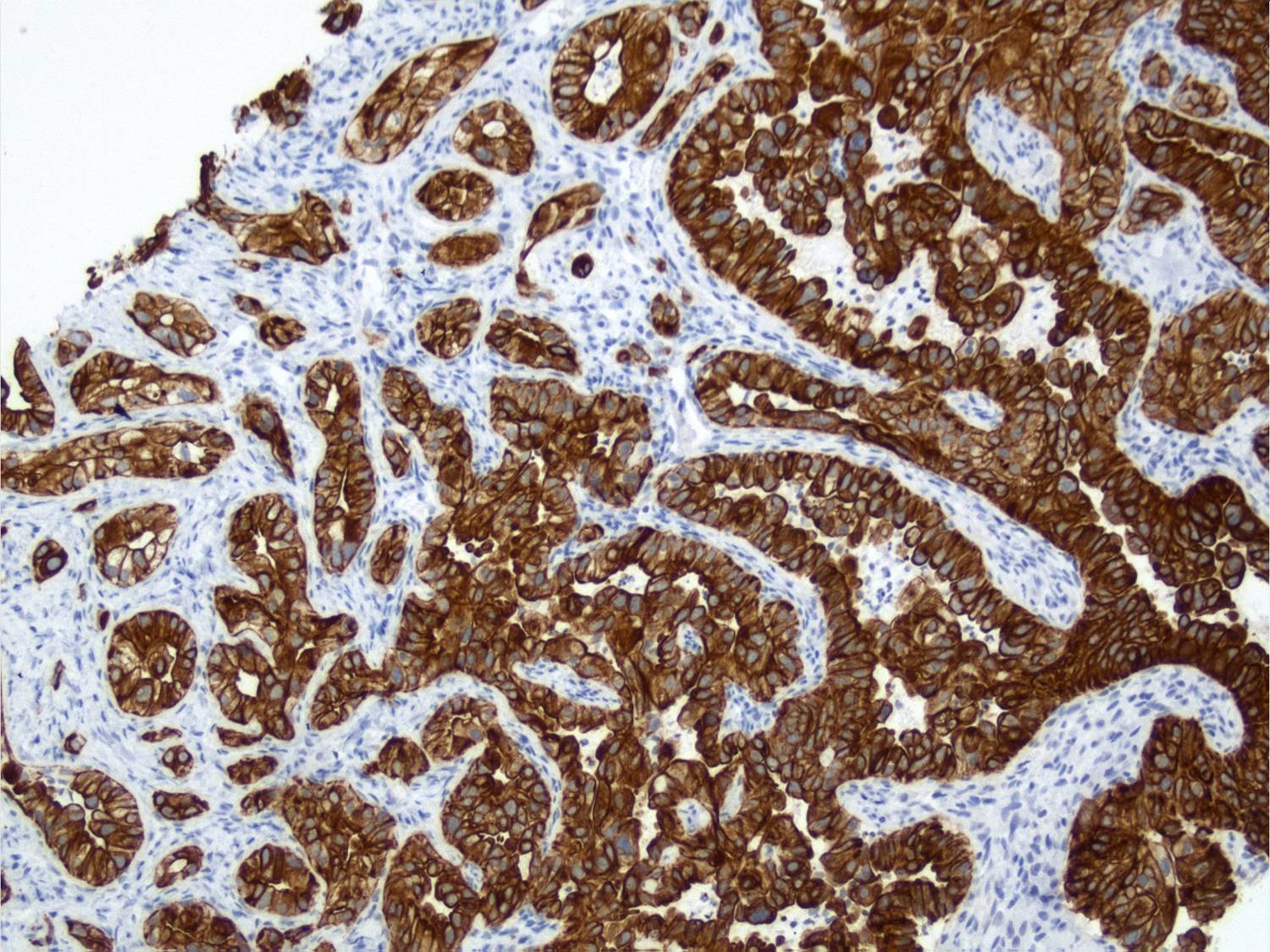
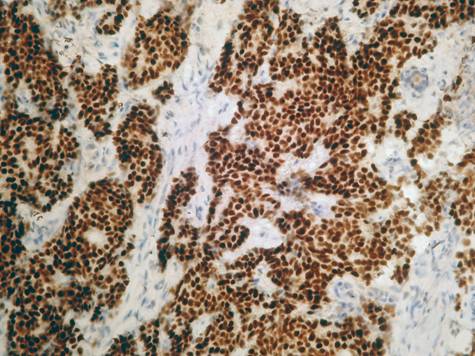
Koexpression von CK 7 und CK19 (Stanzbiopsie einer Knochenmetastase eines Adenokarzinoms der Lunge)
Tumormarker
Abhängig von der Differenzierung bzw. vom Malignitätsgrad eines Karzinoms behalten die Karzinomzellen Eigenschaften des Ursprungsgewebes. Immunhistologisch kann der Pathologe dabei in den Tumorzellen auch bestimmte Proteine nachweisen, die spezifisch in einzelnen Organen gebildet werden und an Hand deren Nachweises sich ein Karzinom einem bestimmten Organ zuordnen lässt. Hierzu gehören bestimmte Hormone wie z.B. Parathormon als Marker für die Nebenschilddrüse oder Thyreoglobulin als Marker für die Schilddrüse. Andere Proteine erlauben eine Eingrenzung auf wenige Organe, wie zum Beispiel der thyreoidale Transkriptionsfaktor-1 (TTF-1), der auf ein Karzinom der Schilddrüse oder Lunge hinweist.
Es gibt darüber hinaus eine Reihe von Antikörpern, die helfen, schwierige differenzialdiagnostische Probleme zu lösen. Die folgende Aufstellung ist sicher nicht vollständig:
-
Calretinin, Thrombomodulin, CEA etc.: bei der Differenzialdiagnose zwischen Mesotheliom und Adenokarzinom der Lunge.
-
PSA, PSAP, Androgenrezeptor, p504s und p501s : als histogenetische Marker des Prostatakarzinoms.
-
AFP, ß-HCG, PLAP, h-PL: als Marker für Keimzelltumoren der Hoden und des Ovars.
-
Ca-125, Inhibin: für bestimmte Ovarialtumoren
-
Östrogen- und Progesteronrezeptor: für Mamma- und Endometriumtumoren
-
Kalzitonin: für medulläre Schilddrüsenkarzinome
-
Ca19-9, CDX2: Karzinome des Gastrointestinaltraktes
-
CEA: in Kombination mit bestimmten Zytokeratinen u.a. für Kolonkarzinome
-
NSE, CD56, CgA, Synaptophysin: für neuroendokrine Karzinome
-
HMB-45, Melan A, S100: für maligne Melanome.
 |
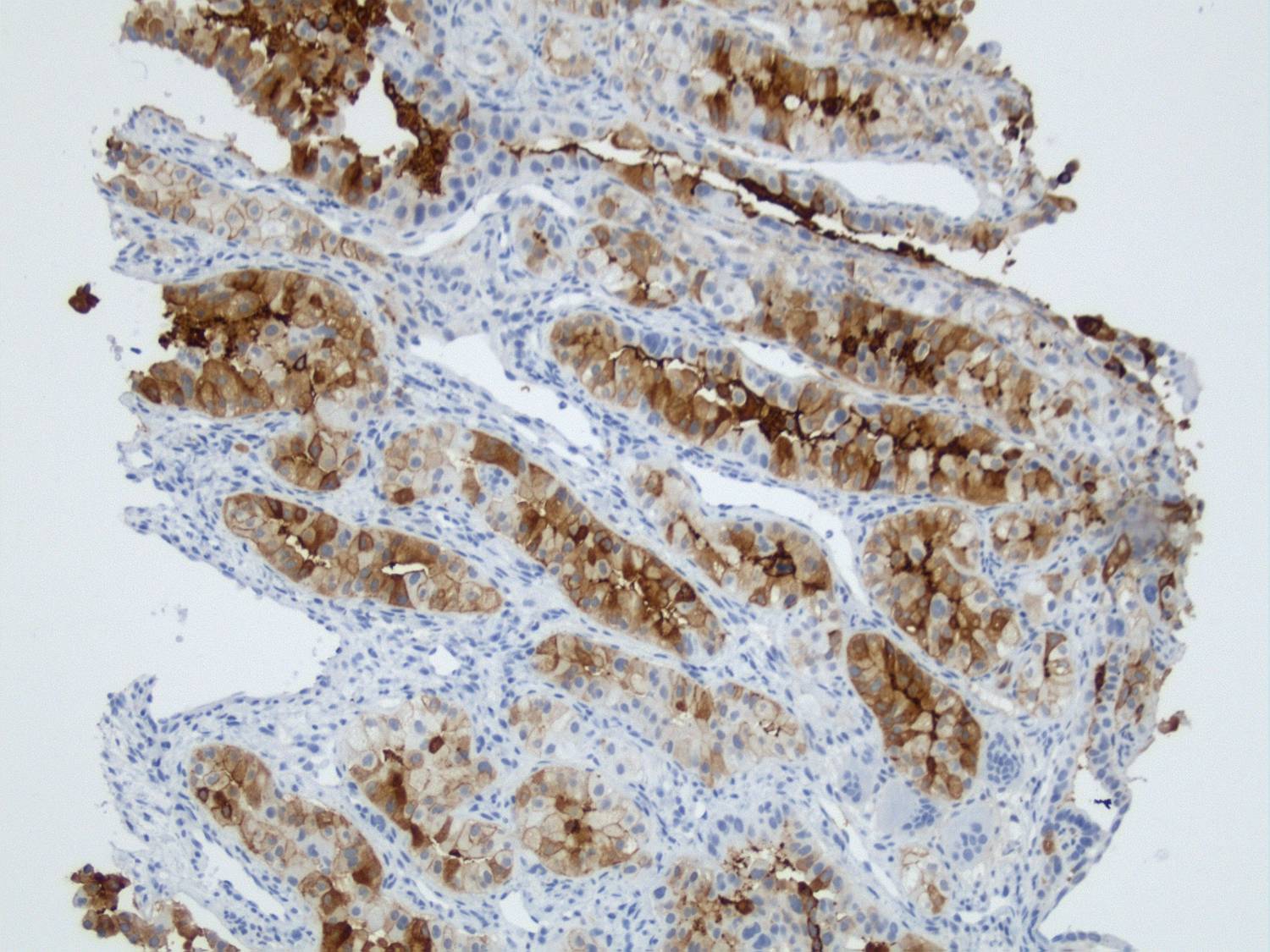 |
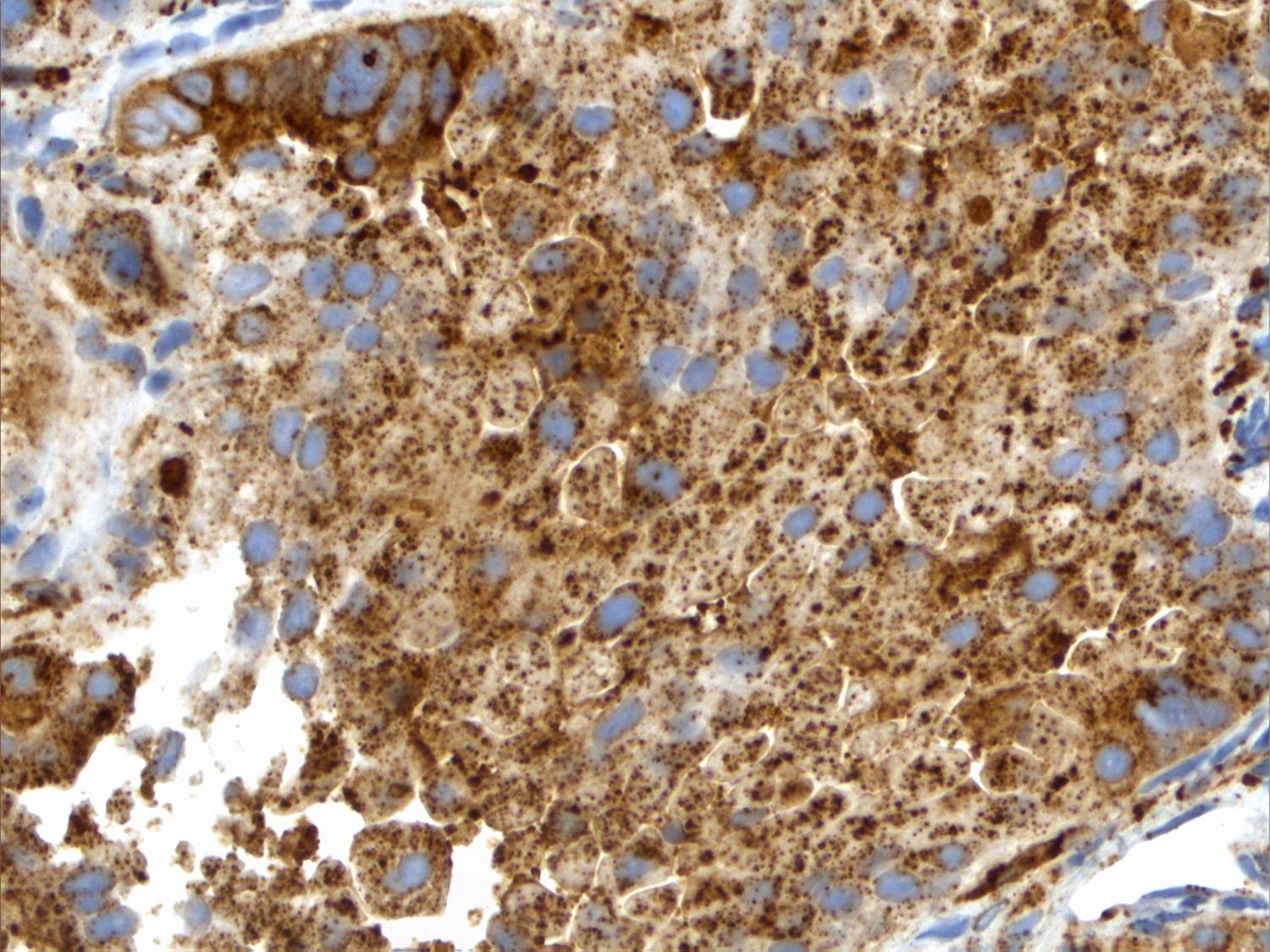 |
TTF1 (oben links), Surfactant A (oben rechts) und Naspin (links unten) in einer Knochenmetastase eines Adenokarzinoms der Lunge. |
Panleukozytenmarker CD45
Das CD45-Antigen ist ein membranständiges Protein, dessen intrazellulärer Abschnitt eine Tyrosin-Phosphatase-Aktivität aufweist. Es wird angenommen, dass CD45 als Oberflächenrezeptor wirkt. Für die immunhistologische Differenzialdiagnostik hat dieses Protein eine herausragende Bedeutung, da es sehr viele Blutzellen verlässlich markiert und als Pan-Leukozytenmarker fungiert. Auf menschlichen Leukozyten kommt das CD45 Antigen in fünf verschiedenen Isoformen vor. Diese haben ein Molekulargewicht von 180 bis 220 kD. Verschiedene Antikörper erkennen unterschiedliche Isoformen, in der Diagnostik wird deshalb ein Gemisch aus zwei monoklonalen Antikörpern (Clon 2B11 und PD7/26) als Pan-Leukozytenmarker verwendet.
Mit dem Pan-Leukozytenmarker werden lymphoide Zellen membranständig markiert. Makrophagen und Histiozyten zeigen ein variables Reaktionsmuster. Neutrophile Granulozyten werden in der Regel nicht markiert, ebenso sind Plasmazellen negativ für CD45.
B-Zellmarker
CD20cy
CD79a
bcl-2
CD5
CD10
CD15
CD23
CD30
CD43
T-Zellmarker
CD3
CD4
CD5
CD8
CD45Ro
CD30
CD56
Vimentin
Vimentin ist das Zytoskelettprotein von mesenchymalen Zellen einschließlich Fibroblasten, Chondrozyten, Osteozyten, Endothelien und weißen Blutkörperchen. Es wird generell in Sarkomen gebildet und wird als übergeordneter Marker für Weichgewebstumoren eingesetzt. Vimentin ist ein Intermediärfilamentprotein vom Typ III (zu dieser Gruppe gehören auch Desmin und das saure Gliafaserprotein GFAP).
Allerdings zeigen auch entdifferenzierte Karzinome eine Expression von Vimentin, dann meist mit einer zumindest partiellen Koexpression von Zytokeratinen. Diagnostisch verwertbar ist die Koexpression von Zytokeratin und Vimentin (eine passende konventionelle Histologie vorausgesetzt) bei
-
Nierenzellkarzinomen
-
Endometriumkarzinomen
-
Synovialissarkomen
-
epitheloiden Sarkomen
Aktin
Aktine sind Zytoskelettproteine, die in allen Eukaryonten vorkommen. Sie bilden neben den Mikrotubuli und den Intermediärfilamenten die dritte Gruppe von filamentären Zytoskelettproteinen. Aktinfilamente sind in der Evolution hoch konserviert. Die Aktinfilamente werden aus helikal angeordneten globulären Aktin-Proteinen mit jeweils 375 Aminosäuren gebildet. Zusammen mit anderen Proteinen (u.a. Myosin) vermitteln die Aktinfilamente Bewegungen.
Aktin wird in allen Muskelzellen gefunden, d.h. quergestreifte Muskulatur, Herzmuskulatur und glatte Muskulatur sind Aktin-positiv. Bei Tumoren, die sich von diesen Geweben ableiten, wird Aktin ebenfalls in fast allen Fällen gebildet. Dies betrifft in erster Linie Leiomyome, Leiomyosarkome und Rhabdomyosarkome. Mit Antikörpern, die zwischen glattmuskulärem und Muskel-spezifischem Aktin unterscheiden, können entsprechende Weichgewebstumoren weiter differenziert werden.
Eine Aktin-Expression findet man auch in einem Teil von pleomorphen Liposarkomen, die dann nicht zu einer Fehlinterpretation führen sollte.
Eine weitere diagnostisch entscheidende Bedeutung kommt der Aktin-Darstellung in Mammakarzinomen zu. Da auch die Myoepithellage Aktin-positiv dargestellt wird, kann man mit der Aktin-Färbung in Zweifelsfällen zwischen invasiven und nicht-invasiven (intraduktalen) Karzinomen unterscheiden.
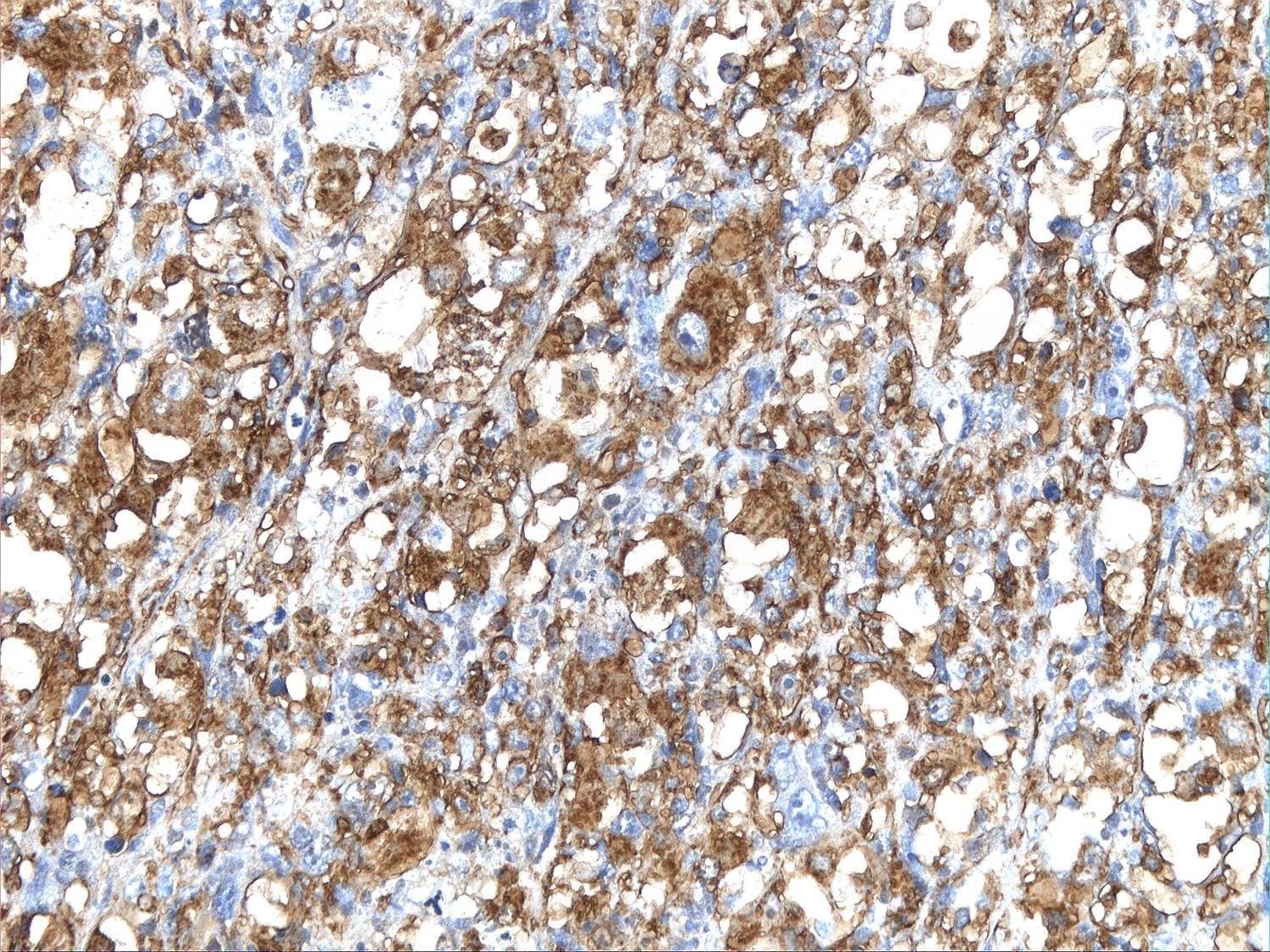
 Die nebenstehende Mikrographie zeigt ein Beispiel eines Mammakarzinoms. Unten links ist ein Milchgang mit intakter Myoepithellage angeschnitten, der große Epithelkomplex oben rechts weist sich durch die fehlende Myoepithellage als invasiv aus, obwohl er konventionell-histologisch eher an ein intraduktales Karzinom denken lässt. Im Stroma zeigen auch die Myofibroblasten eine Aktin-Positivität.
Die nebenstehende Mikrographie zeigt ein Beispiel eines Mammakarzinoms. Unten links ist ein Milchgang mit intakter Myoepithellage angeschnitten, der große Epithelkomplex oben rechts weist sich durch die fehlende Myoepithellage als invasiv aus, obwohl er konventionell-histologisch eher an ein intraduktales Karzinom denken lässt. Im Stroma zeigen auch die Myofibroblasten eine Aktin-Positivität.
Gesamt-Aktin in einem Leiomyosarkom
Desmin
Desmin ist ein Intermediärfilament, das sowohl in glatter als auch quergestreifter Muskulatur zu finden ist. Daneben wird auch in selten in anderen Geweben gefunden (z.B. endometrielles Stroma und submesotheliale Fibroblasten, Myofibroblasten). Desmin gilt als sehr sensitiver Marker einer myogenen Differenzierung auch in Tumoren. Auch schlecht differenzierte Rhabdomyosarkome exprimieren noch diesen Marker.
Eine Desmin-Expression kann aber auch in manchen anderen Tumoren gefunden werden, ohne dass dieses eine myogene Differenzierung anzeigt:
-
PNET
-
Desmoplastischer Rundzelltumor
-
Neuroblastom
-
Mesothel und abgeleitete Tumoren
-
Wilms-Tumor
-
Riesenzelltumor der Sehnenscheide
-
angiomatoides fibröses Histiozytom
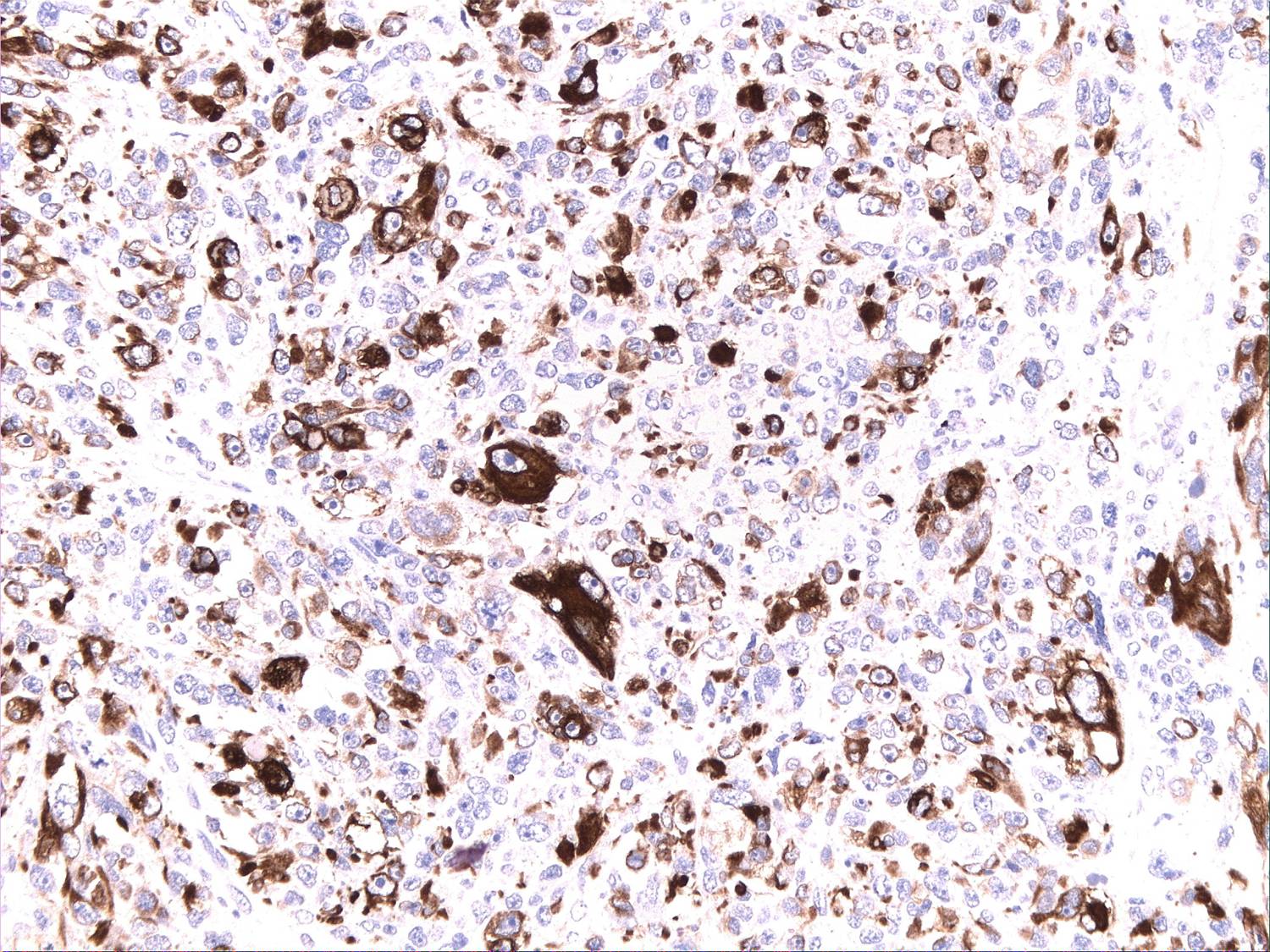
Desmin in einem Leiomyosarkom
CD34
Das CD34-Antigen ist ein membranständiges Protein mit einem Molekulargewicht von 116 kD. Es wird in unreifen hämatopoetischen Stammzellen gebildet. Dieses Antigen und wird auch genutzt, um hämopoetische Stammzellen aus dem peripherem Blut für eine Stammzelltransplantation anzureichern. Daneben wird das CD34-Antigen auch auf Kapillarendothelien und in embryonalen Fibroblasten gebildet. Mit zunehmender Reifung verschwindet die Expression von CD34.
Eine CD34-Expression wird in undifferenzierten Leukämien, akuten myeloischen Leukämien und akuten lymphoblastischen Leukämien gefunden. Unter den Weichgewebstumoren reagieren insbesondere Gefäßtumoren mit diesem Marker. U.a. zeigt auch das Kaposi-Sarkom eine CD34-Positivität.
Daneben eignet sich der Marker auch für die Darstellung von Kapillarendothelien zum Beweis einer Lymph- oder Hämangiosis carcinomatosa.
Bestimmte weitere seltene Weichgewebstumoren sind ebenfalls CD34-positiv. Dazu gehören
-
das Dermatofibrosarcoma protuberans,
-
der solitäre fibröse Tumor,
-
das Spindelzelllipom
-
die gastrointestinalen Stromatumoren,
-
maligne periphere Nervenscheidentumoren und
-
epitheliode Sarkome.
In der Kombination mit CD31, einem Antigen mit hoher Spezifität für eine vaskuläre Differenzierung, erreicht man eine gute Absicherung einer entsprechenden Histogenese.
S100-Protein
S100 stellt eine Gruppe von relativ kleinen Proteinen dar, die als gemeinsame Eigenschaft Kalzium-Ionen binden und dann in Abhängigkeit von der intrazellulären Kalzium-Konzentration andere Proteine (u.a. Proteinkinasen) aktivieren. Sie sind somit an der Signaltransduktion von Kalzium-abhängigen Signalwegen beteiligt. Der Name dieser Proteinfamilie leitet sich von der Eigenschaft ab, dass diese Proteine in 100% gesättigter Ammoniumsulfat-Lösung löslich bleiben, während andere Proteine ausfallen.
Auf Grund der geringen Größe der S100-Proteine ist eine Formalinfixierung zur Darstellung im Gewebe notwendig. Aus Kryostatschnitten und unzureichend fixiertem Gewebe kann es heraus gewaschen werden.
S100-Proteine findet sich in Glia und Ependymzellen des ZNS. Auch die Glia der peripheren Nerven, also die Schwannschen Zellen färben sich an. Entsprechend findet man eine Positivität für S100 in Tumoren, die sich von diesen Geweben ableiten. Zusätzlich sind Melanozyten sowie melanozytäre Tumoren S100-positiv. Bei malignen Melanomen findet sich meist auch dann noch eine S100-Positivität, wenn andere melanozytäre Marker auf Grund einer fortschreitenden Entdifferenzierung nicht mehr gebildet werden.
Speicheldrüsentumoren und Tumoren der ekkrinen Schweißdrüsen zeigen häufig ebenfalls eine Expression von S100.
Neuronen-spezifische Enolase / Chromogranin A / Synaptophysin
Neuroendokrine Marker
Synaptophysin, Chromogranin A, NSE, CD56
Synaptophysin ist ein Protein, das in neuroendokrinen Zellen gebildet wird. Eine Expression findet sich auch in Tumoren, die sich von den neuroendokrinen Zellen ableiten. Diese findet man im Gastrointestinaltrakt, im Pankreas, der Lunge, Schilddrüse und der Hypophyse. Auch die Zellen des Nebennierenmarks und der Paraganglien reagieren positiv.
Das Chromogranin A (CgA) färbt eine ähnliche Palette von Geweben, genauso wie die Neuronen-spezifische Enolase (NSE), die auch zusätzlich in neuronalen Geweben gefunden wird.
CD56 entspricht dem neuronalen Zelladhäsionsmolekül (NCAM). Es ist ein sehr sensitiver Marker einer neuroendokrinen Differenzierung und wird entsprechend seiner Funktion als Adhäsionsmolekül an der Zelloberfläche membranös exprimiert. Es wird auch in nasalen T/NK-Zell-Lymphomen exprimiert.
HMB45
Der Antikörperklon HMB45 färbt ein zytoplasmatisch lokalisiertes Antigen (gp100) in Melanozyten und melanozytären Tumoren an. Das Antigen repräsentiert eine Komponente der melanosomalen Oxidoreduktasen und ist somit Melanosomen-spezifisch. HMB-45 lässt sich in ca. 85% der malignen Melanome nachweisen, wobei aber die Untergruppe der desmoplastischen Melanome in weniger als 10 % positiv sind.
Eine HMB-45-Positivität wird auch in Angiomyolipomen, Klarzelltumoren der Lunge und in der Lymphangioleiomyomatose gefunden.
Nävi und ruhende Melanozyten sind in der Regel negativ.
Östrogen- und Progesteronrezeptor
|
Starke Expression der Östrogenrezeptoren in einem Mammakarzinom |
Die Östrogen- und Progesteronrezeptoren spielen in mehrfacher Hinsicht eine wichtige Rolle bei der Diagnostik und Therapie des Mammakarzinoms aber auch bei Tumoren des weiblichen Genitaltraktes . Hormonelle Imbalancen, insbesondere ein endogener Östrogenüberschuss, sind ein Risikofaktor für die Entwicklung eines Mammakarzinoms. Die antiöstrogene Therapie ist mittlerweile Standard in der adjuvanten Therapie des Mammakarzinoms. In der histologischen Diagnostik repräsentiert die Expression der Östrogen- und Progesteronrezeptoren einen wichtigen Baustein bei der Klärung der Histogenese von Metastasen eines unbekannten Tumors.
Östrogen und Progesteron sind Steroidhormone. Ihre Rezeptoren sind im Kern der Zielgewebe (u.a. Mamma und Uterus) lokalisiert. Nach der Bindung des Östrogens oder Progesterons an den jeweiligen Rezeptor bindet dieser Ligand-Rezeptor-Komplex an bestimmte Stellen auf der DNA und ermöglicht dabei das Ablesen (die Transkription) bestimmter Gene, die verstärkt exprimiert werden.
|
Starke Expression der Progesteronrezeptoren in einem Mammakarzinom |
In Tumoren werden mehrere Wachstumsfaktoren östrogenabhängig produziert. Mit diesen Wachstumsfaktoren können sich die Tumorzellen selbst stimulieren (eine so genannte autokrine Regulation) und erreichen so eine höhere Wachstumsrate und Aggressivität. Durch die Blockade des Östrogenrezeptors und die damit verbundene Reduktion der Bildung verschiedener Wachstumsfaktoren kann man so gleichzeitig mehrere autokrine Regulationsschleifen in östrogenabhängigen Tumoren unterbinden. Für die Therapie mit antiöstrogenen Medikamenten ist die Kenntnis des Hormonrezeptorstatus absolut wichtig.
Früher wurden die Hormonrezeptoren biochemisch in extra aufbereitetem Tumorfrischgewebe bestimmt. Hierbei kam ein direkter Radioliganden-Assay mit radioaktiv markiertem Östrogen zum Einsatz. Seit mehreren Jahren hat sich aber die i mmunhistologische Bestimmung, initial am Gefrierschnitt, jetzt fast ausschließlich am Paraffinmaterial durchgesetzt. Die immunhistologischen Ergebnisse korrelieren sehr gut mit dem Radioliganden-Assay. Obwohl die immunhistologische Bestimmung des Rezeptorstatus nur eine semiquantitative Erfassung zulässt, ist sie der biochemischen Bestimmung insofern überlegen, als im Schnitt ausschließlich die Tumorzellen bewertet werden und auch falsch-positive (z.B. zytoplasmatische Positivität) oder falsch-negative (z.B. durch inhomogene Anfärbung) Ergebnisse besser erfasst werden können. Der immunhistologischen Rezeptorbestimmung wird deshalb eine höhere Wertigkeit beigemessen.
In Deutschland hat sich der so genannte Remmele-Score (auch immunreaktiver Score, IRS) zur Bewertung des Färbeergebnisses durchgesetzt.
|
Es wird das Produkt der Punkte für Färbeintensität und des Anteils positiver Kerne gebildet. Es resultiert ein Score von 0 bis 12. Ein negativer Rezeptorstatus ist zur Zeit nicht verbindlich definiert und lässt sich nicht aus dem IRS ableiten. Nach Definition der AGO besteht eine antihormonelle Behandlungsindikation, wenn mehr als 10% der Tumorzellen den Östrogen- und/oder den Progesteronrezeptor exprimieren. Nach Skt. Gallen 2005 gelten Tumoren mit 1 bis 10% positiven Tumorzellen als fraglich positiv.
Trotz der Unsicherheit bei der Grenzziehung ist eines klar: die Grenze, die über die Behandlungsindikation entscheidet, liegt im Bereich der schwach exprimierenden Mammakarzinome. Dies unterstreicht die Notwendigkeit einer hohen Sensitivität der Färbung. Als Instrument der externen Qualitätssicherung werden auf freiwilliger Basis Ringversuche mit Testfällen durchgeführt.
Her2/neu
Her2 ist eine der typischen molekularbiologischen Abkürzungen, deren Herkunft sich meist kaum noch rekonstruieren lässt. Es steht für human epidermal growth receptor 2. Her2/neu ist ein membranständiger Rezeptor, der auf der Oberfläche von Tumorzellen überexprimiert werden kann. Der Rezeptor gehört zu den Tyrosinkinase-Rezeptoren, d.h. die intrazelluläre Domäne besitzt eine enzymatische Aktivität, die Phosphatgruppen an Tyrosinreste der intrazellulären Effektormoleküle koppelt (Tyrosinkinase-Aktivität). Her2/neu wird vom c-erbB2-Gen (c-erbB2 steht für cellular avian erythroblastosis homologue B2) kodiert und entspricht einem viralen Onkogenhomolog, das bei Vögeln eine Leukämie hervorruft..
Die häufigste (und fast alleinige) Ursache einer Her2/neu-Überexpression in Mamma-karzinomen ist eine Vervielfältigung
( Gen-Amplifikation) des c-erbB2-Gens, d.h. das Gen liegt in mehr als 2 Kopien im Zellkern vor. Die c-erbB2-Amplifikation und die konsekutive Her2/neu-Überexpression ist mit einer schlechteren Prognose bei Mammakarzinomen assoziiert. Gleichzeitig stellt aber Her2/neu ein therapeutisches Zielprotein dar. Mit einem humanisierten Antikörper (d.h. einem Antikörper, der vom menschlichen Immunsystem nicht als körperfremd erkannt wird) gegen Her2/neu können überexprimierende Tumorzellen bekämpft werden. In der Tat stellen die Studien zur Behandlung mit dem Antikörper seit sehr langer Zeit die ersten Therapieergebnisse dar, die in einer verlängerten Überlebenszeit bei Mammakarzinomen resultierten. Zudem gibt es Studien, die bei Her2/neu-Überexpression ein längeres krankheitsfreies Überleben und eine längere Gesamtüberlebenszeit nach einer speziellen Chemotherapie zeigen.
Die Indikation für die Herceptin-Therapie ist auf stark überexprimierende Tumoren beschränkt, bei mäßig überexprimierenden Karzinomen muss eine entsprechende Genamplifikation nachgewiesen werden. Die Genamplifikation wird durch die Fluoreszenz-in-situ-Hybridisierung (FISH) dargestellt. Aufgrund der besseren Verfügbarkeit erfolgt der Her2/neu -Nachweis meist immunhistologisch. Die Färbung erfolgt mit einem Färbekit der Firma DAKO, der von der amerikanischen FDA als einziges immunhistologisches Verfahren zugelassen ist, aber auch ausgesprochen teuer ist. Trotzdem ist FISH die validere Methode, über die Behandlungsindikation zu entscheiden.
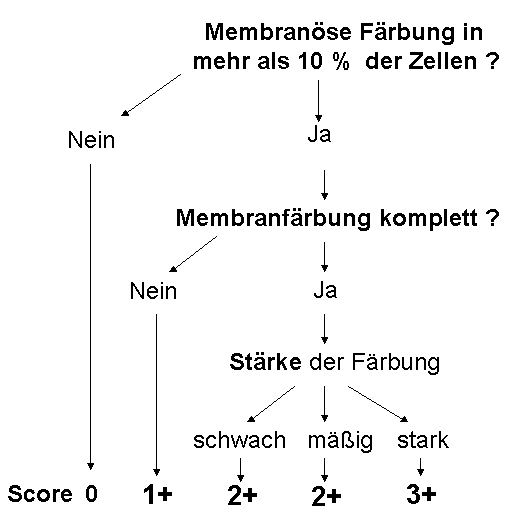
Auswertung
Das Färbeergebnis wird als vierstufiger Score von “0” bis “3+” mitgeteilt. Für den Score
werden die
-
Stärke der Färbung,
-
die Anzahl der positiven Zellen und
-
die Qualität/Lokalisation des Signals bewertet.
Berücksichtigt werden ausschließlich Färbesignale der Zellmembran. Es wird dann zunächst entschieden, ob mehr oder weniger als 10% der Tumorzellen angefärbt sind. Jede Markierung, die weniger als 10% der Tumorzellen betrifft, wird als negativ (Score 0) bewertet. Ein weiteres übergeordnetes Kriterium bei der Auswertung ist, ob die Färbung die Zellmembran in der vollen Zirkumferenz markiert oder nur teilweise anfärbt. Schließlich wird die Färbeintensität bewertet. Der Entscheidungsbaum ist im Folgenden abgebildet. Zur Reduktion falsch positiver Ergebnisse ist der Score 3+ seit 2008 auf Fälle beschränkt, bei denen mindestens 30% der Zellen eine starke zirkumferentielle Anfärbung zeigen. Fälle mit 10 bis 30% stark positiver Zellen werden nach 2+ klassifiziert. Diese Änderung ist Teil der aktuellen S3-Leitlinien zum Mammakarzinom.
 |
Schlussfolgerung:
|
Bei einem negativem Ergebnis im Primärtumor sollte man auch Gewebe aus Metastasen oder dem Rezidiv gewinnen und untersuchen, insbesondere wenn sie metachron auftreten, denn diese könnten eine starke Überexpression aufweisen und mit der Herceptin-Therapie werden genau diese Tumormanifestationen behandelt. Dabei sollte auch bedacht werden, dass die Fluorezenz-in-situ-Hybridisierung sehr gut geeignet ist, auch an Feinnadelpunktaten aus einer Metastase eine Genamplifikation nachzuweisen.
p53
p53 ist ein Tumorsuppressorgen mit einem Molekulargewicht von 53 kD. Das Gen von p53 ist auf dem kurzen Arm des Chromosom 17 lokalisiert. Das Genprodukt ist nukleär lokalisiert und stellt ein zentrales Protein der Zellzykluskontrolle dar. Die zentrale Funktion von p53 ist es, Zellen, die genetische Schäden aufweisen, nicht mehr zur Vermehrung zuzulassen. Diese Zellen gehen dann durch Apoptose zugrunde. Die Apoptose ist ein mehrstufiger Mechanismus, der einem physiologischen Selbstmord der Zelle gleich kommt. Wenn die Funktion von p53 durch eine Mutation im Gen eingeschränkt oder aufgehoben ist, können genetisch geschädigte Zellen nicht mehr aussortiert werden und so können sich im Laufe von mehreren Zellzyklen genetische Schäden anreichern.
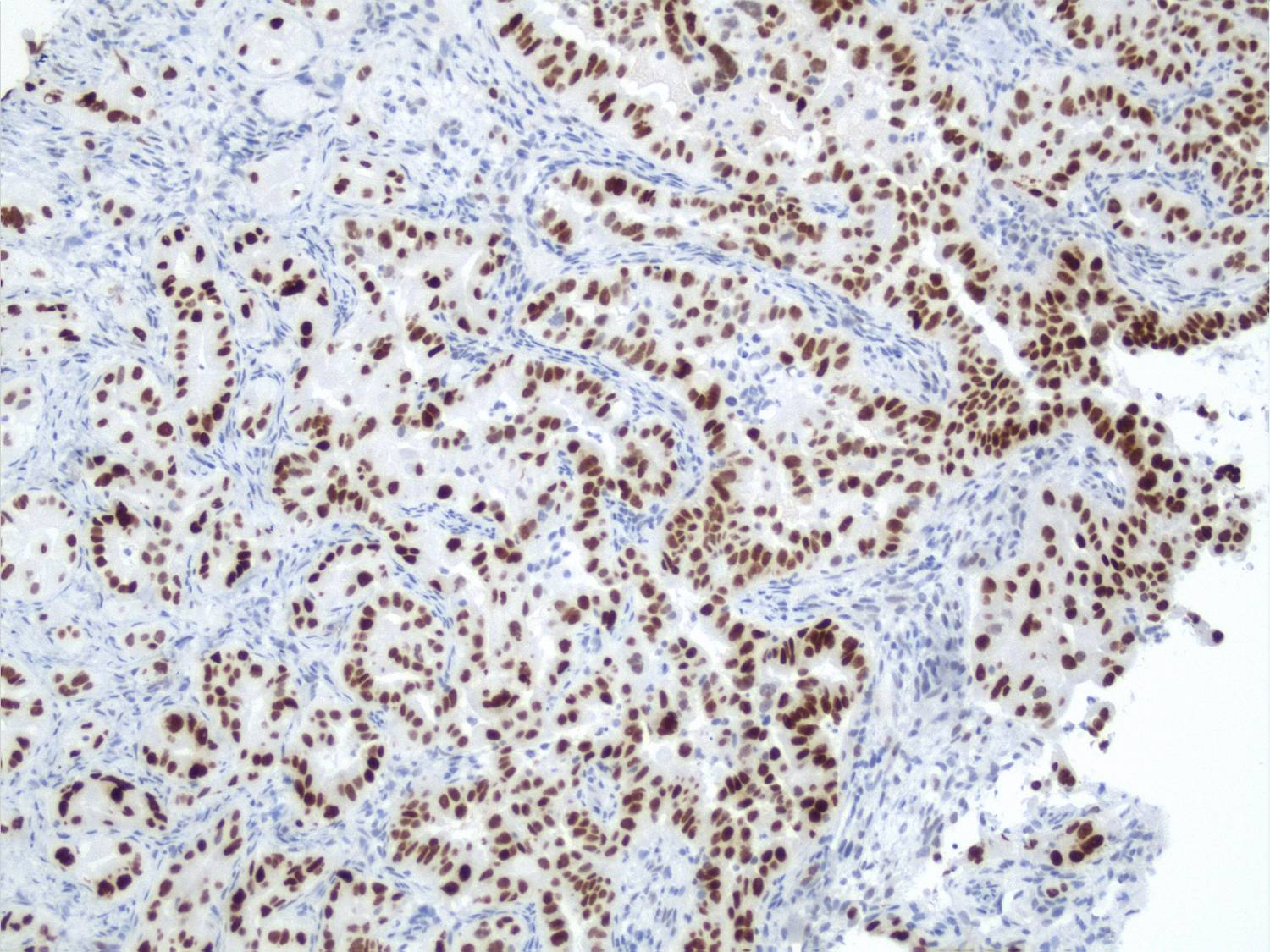
In normalen Geweben wird p53 nur in geringer Menge exprimiert, so dass es mit immunhistologischen Mitteln in der Regel nicht nachweisbar ist. Wenn allerdings eine Punktmutation im p53-Gen vorhanden ist, die die Funktion des Proteins einschränkt, reichert sich das defekte Protein im Kern an. Es kann dann immunhistologisch nachgewiesen werden. Punktmutationen des p53-Gen kommen in malignen Tumoren unterschiedlicher Histogenese sehr häufig vor. Verwertbar als Malignitätskriterium ist eine kräftige nukleäre Expression in nahezu allen Tumorzellen. Nur ein solches Färbemuster lässt auf eine zugrunde liegende Punktmutation schließen.
|
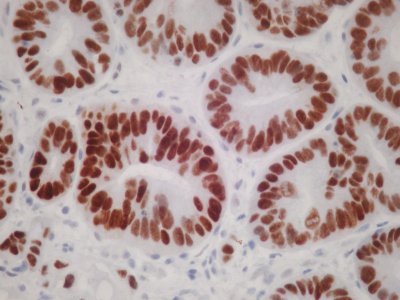
Starke nukleäre p53-Expression in einer High-grade Neoplasie auf dem Boden einer Barrett-Mukosa |
Die Färbung für p53 hat nur bei bestimmten Fragestellungen ein besonderes Gewicht. Bei Biopsaten aus der Region der Papilla Vateri sind adenomatöse Läsionen mit einer Expression von p53 als schwerwiegender einzuschätzen und können auf eine bereits erfolgte maligne Entartung hinweisen. Auch bei der Beurteilung von Dysplasien einer Barrett-Mukosa kommt dem Färbeergebnis für p53 ein relatives Gewicht bei der Dignitätsbestimmung zu.
Das Ki67-Antigen
Das Ki67-Antigen ist ein Proliferationsmarker, d.h. er färbt die Zellen im Gewebe an, die sich vermehren, die so genannte Wachstumfraktion. Während des Zellzyklus wird dieses Antigen in der G1-, in der S-, in der G2- und in der M-Phase exprimiert. Ruhende Zellen, also Zellen, die sich in der G0-Phase befinden, exprimieren das Ki67-Antigen nicht. Die Färbung für Ki67 gibt also mittelbar Aufschluss über die Wachstumsgeschwindigkeit eines Tumors und ist deshalb in der Routinediagnostik von unschätzbaren Wert. Aber auch in der Entscheidung zwischen benignen, präneoplastischen und malignen Veränderungen kann die Darstellung des Ki67-Antigen wertvolle Hilfestellungen geben.
Es gibt verschiedene Antikörper gegen Ki67. Der Antikörperklon, der diesem Antigen seinen Namen gab (Ki steht dabei für Kiel und weist auf das Institut für Pathologie der Kieler Universitätsklinik hin), funktionierte nur zuverlässig an Kryostat-Schnitten und war für die Routinediagnostik nur eingeschränkt geeignet. Der Klon MIB-1 war dann der erste Paraffin gängige Antikörper, mit dem das Ki67-Antigen auch in der Routinehistologie dargestellt werden konnte. Übrigens, die Abkürzung für MIB – auch das sollte man als Schleswig-Holsteiner wissen – steht für “made in Borstel”. Wir verwenden in der Diagnostik den Paraffin gängigen Klon KiS5 (richtig, der kommt aus der Landeshauptstadt!).
|
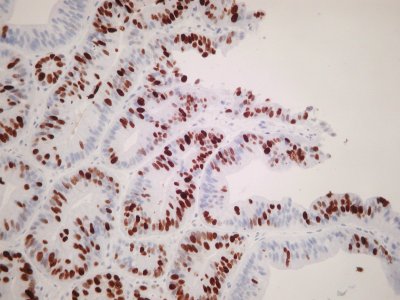
Reaktive Veränderungen des Epithels in einer Barrett-Mukosa: Das Epithel reift zur Oberfläche aus. Im Oberflächenepithel sind keine proliferativen Zellen zu erkennen. Die Topik der normalen Mukosa ist in Hinblick auf die Proliferationskinetik erhalten. |
|
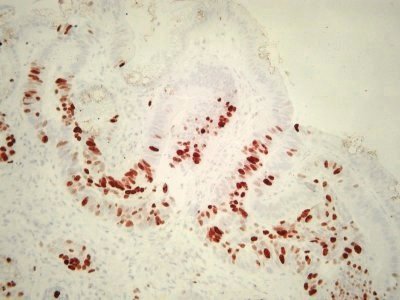
Dysplastische Veränderungen in einer Barrett-Mukosa (high-grade Neoplasie): Das proliferative Zelllager erstreckt sich bis in das Oberflächenepithel. Als Zeichen der zellulären Desorganisation erfolgt zur Oberfläche keine Ausreifung. |